
题目列表(包括答案和解析)
| 元素编号 | 元素性质或原子结构 |
| A | 有三个电子层,K、M层电子数之和等于L层电子数 |
| B | 短周期中金属性最强 |
| C | 常温下单质为双原子分子,氢化物的水溶液呈碱性 |
| D | 元素最高正价是+7价 |
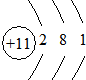
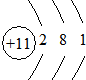
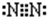
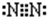
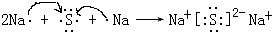
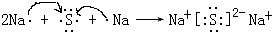
| O2 |
| O2 |
| H2O |
 已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于前三周期.A位于周期表的s区,其原子中电子层数和未成对电子数相同;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子的核外成对电子数是未成对电子数的3倍.A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,E是过渡元素且为地壳中含量较多的金属元素之一.请回答下列问题:
已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于前三周期.A位于周期表的s区,其原子中电子层数和未成对电子数相同;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子的核外成对电子数是未成对电子数的3倍.A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,E是过渡元素且为地壳中含量较多的金属元素之一.请回答下列问题:
| ||
| ||

| 元素编号 | 元素性质或原子结构 |
| A | 有三个电子层,K、M层电子数之和等于L层电子数 |
| B | 短周期中金属性最强 |
| C | 常温下单质为双原子气态分子,氢化物的水溶液呈碱性 |
| D | 元素最高正价是+7价 |



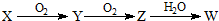
 HCN+OH-
HCN+OH- HCN+OH-
HCN+OH-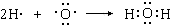
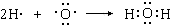
| ||
| ||
1―20 DABBC BCCBD BCDAC BBDCB
21.(7分)(1) 硫或S(1分)
(2)A1(OH)3;(2分)Al3++3HCO ===Al(OH)3↓+3CO2↑(2分)
===Al(OH)3↓+3CO2↑(2分)
(3)BaCO3,可能含有BaSO4(2分)
(4)2S2-+SO +6H+=3S↓+2H2O(2分)
+6H+=3S↓+2H2O(2分)
(5)S2―、
SO =AlO
=AlO 、Na+(4分)
、Na+(4分)
22.(14分)
(1)除去沾有的油污(2分)
(2)反应速率慢 不利于昌体析出。(2分)增大FeSO4的溶解量(2分)
(3)水浴加热均匀,温度容易控制。(2分)
(4)Fe3++2Fe=3Fe2+(2分)
(5)减少FeSO4的损失(2分)
(6)有浅绿色晶体析出(2分)
23.2.物质结构与性质
(1)CaCl2。(2分)Ca2+[x C Cx] 2―
Cx] 2―
(2) (2分)S=C=S(2分)H2S(2分)
(2分)S=C=S(2分)H2S(2分)
(3)Si3N4。
(4)4H-+SiO2=SiF4+2H2O(2分)
24.27.(17分)
(1)  (2分)
(2分)
(2)2NH3(l) NH
NH NH
NH (2分)
(2分)
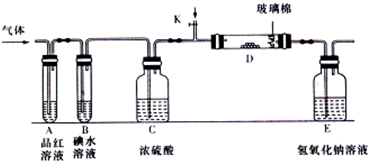
(3) ①打开止水夹,通入少量氧气(2分)
②P2O5+6OH-=2PO43-+3H2O(2分)
③Cu片逐渐溶解,有无色气泡产生,溶液由无色变为蓝色(3分)
3Cu+8H++2NO =3Cu2++2NO
=3Cu2++2NO +4H2O(2分)
+4H2O(2分)
(4) ①2NO 2NO+O2(2分)
2NO+O2(2分)
②30.7(2分)
 w.w.w.k.s.5.u.c.o.m
w.w.w.k.s.5.u.c.o.m
www.ks5u.com
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com