
题目列表(包括答案和解析)
(12分)某研究小组在实验室探究氨基甲酸铵(NH2COONH4)分解反应平衡常数。
(1)将一定量纯净的氨基甲酸铵固体置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:
NH2COONH4(s)  ?2NH3(g)+CO2(g)
?2NH3(g)+CO2(g)
实验测得不同温度下的平衡数据列于下表:
|
温度/℃ |
15.0 |
20.0 |
25.0 |
30.0 |
35.0 |
|
平衡总压 强/kPa |
5.7 |
8.3 |
12.0 |
17.1 |
24.0 |
|
平衡气体 总浓度/ mol·L-1 |
2.4× 10-3 |
3.4× 10-3 |
4.8× 10-3 |
6.8× 10-3 |
9.4× 10-3 |
(1)可以判断该分解反应已经达到平衡的是( )
A.2v(NH3)=v(CO2)
B.密闭容器中总压强不变
C.密闭容器中混合气体的密度不变
D.密闭容器中氨气的体积分数不变
(2)该分解反应的平衡常数表达式为____________________________,根据表中数据,列式计算25.0 ℃时的分解平衡常数:____________________。(保留两位有效数字)
(3)取一定量的氨基甲酸铵固体放在一个带活塞的密闭真空容器中,在25.0 ℃下达到分解平衡。若在恒温下压缩容器体积,氨基甲酸铵固体的质量________(填“增加”“减少”或“不变”);
(4)氨基甲酸铵分解反应的焓变ΔH________0(填“>”“=”或“<”),熵变ΔS________0 (填“>”“=”或“<”)。此反应在该温度下能自发进行原因是 ________ 效应大于 ___________效应.
(10分)某研究小组在实验室探究氨基甲酸铵(NH2COONH4)分解反应平衡常数的测定。将一定量纯净的氨基甲酸铵置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),使其达到分解平衡:NH2COONH4(s) 2NH3(g)+CO2(g)。
2NH3(g)+CO2(g)。
实验测得不同温度下的平衡数据列于下表:
| 温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡总压强(kPa) | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| 平衡气体总浓度 (×10-3mol/L) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
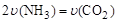
(12分)某研究小组在实验室探究氨基甲酸铵(NH2COONH4)分解反应平衡常数。
(1)将一定量纯净的氨基甲酸铵固体置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:
NH2COONH4(s) ?2NH3(g)+CO2(g)
?2NH3(g)+CO2(g)
实验测得不同温度下的平衡数据列于下表:
| 温度/℃ | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡总压 强/kPa | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| 平衡气体 总浓度/ mol·L-1 | 2.4× 10-3 | 3.4× 10-3 | 4.8× 10-3 | 6.8× 10-3 | 9.4× 10-3 |
(10分)某研究小组在实验室探究氨基甲酸铵(NH2COONH4)分解反应平衡常数的测定。将一定量纯净的氨基甲酸铵置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),使其达到分解平衡:NH2COONH4(s) 2NH3(g)+CO2(g)。
2NH3(g)+CO2(g)。
实验测得不同温度下的平衡数据列于下表:
|
温度(℃) |
15.0 |
20.0 |
25.0 |
30.0 |
35.0 |
|
平衡总压强(kPa) |
5.7 |
8.3 |
12.0 |
17.1 |
24.0 |
|
平衡气体总浓度 (×10-3mol/L) |
2.4 |
3.4 |
4.8 |
6.8 |
9.4 |
(1)可以判断该分解反应已经达到化学平衡的是___________。
A.
B.密闭容器中总压强不变
C.密闭容器中混合气体的平均相对分子质量不变
D.密闭容器中气体密度不变
(2)根据表中数据,列式计算15.0℃时的分解平衡常数:__________________________。
(3)取一定量的氨基甲酸铵固体放在一个带活塞的密闭真空容器中,在25℃下达到分解平衡。若在恒温下压缩容器体积,氨基甲酸铵固体的质量______(填“增加”、“减小”或“不变”)。
(4)氨基甲酸铵分解反应的焓变△H____0,熵变△S___0(填>、<或=)。
Ⅰ.含氮化合物西瓜膨大剂别名氯吡苯脲,是经过国家批准的植物生长调节剂,实践证明长期使用对人体无害。已知其相关性质如下表所示:
|
分子式 |
结构简式 |
外观 |
熔点 |
溶解性 |
|
C12H10ClN3O |
|
白色结晶粉末 |
170~172℃ |
易溶于水 |
(1)氯吡苯脲的晶体类型为_______ ,所含第二周期元素第一电离能从大到小的顺序为
________________(用元素符号表示)。
(2)氯吡苯脲熔点低,易溶于水的原因分别为 _ 。
(3)查文献可知,可用2-氯-4-氨基吡啶与异氰酸苯酯反应,生成氯吡苯脲。
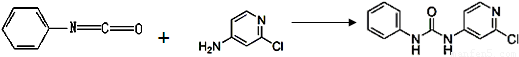
异氰酸苯酯 2-氯-4-氨基吡啶 氯吡苯脲
反应过程中,每生成1mol氯吡苯脲,断裂_______个σ键、断裂_______个π键。
(4)含氮的化合物氨气水溶液逐滴加入硝酸银溶液中制备银氨溶液,写出银氨溶液的配制过程中沉淀溶解的离子方程式 。
Ⅱ.下列是部分金属元素的电离能
|
|
X |
Y |
Z |
|
第一电离能(kJ/mol) |
520.2 |
495.8 |
418.8 |
(5)已知X、Y、Z的价层电子构型为ns1,则三种金属的氯化物(RCl)的熔点由低到高的顺序为:
。
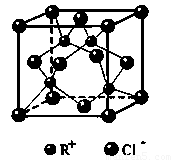
(6)RCl可用作有机合成催化剂, 并用于颜料, 防腐等工业。R+中所有电子正好充满K、L、M 三个电子层,它与Cl-形成的晶体结构如下图所示。元素R基态原子的电子排布式 _ ,
与同一个Cl-相连的 R+有 个。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com