
题目列表(包括答案和解析)
(10分)![]() 近年来发光材料应用广泛,基于发光的有机金属配合物的电致发光器件作为新一代显示器和传感器所具有的良好性能引起了人们极大的兴趣。金属配合物的性质介于有机物和无机物之间,具有有机物的高荧光量子效率的优点,其稳定性又可与无机化合物相媲美,被认为是最有前途的一类发光材料。下面是合成一种配体的路线,该产物与铜(Ⅱ)的配合物是一种可发蓝光的发光材料,在电致发光器材方面有很好的应用前景。
近年来发光材料应用广泛,基于发光的有机金属配合物的电致发光器件作为新一代显示器和传感器所具有的良好性能引起了人们极大的兴趣。金属配合物的性质介于有机物和无机物之间,具有有机物的高荧光量子效率的优点,其稳定性又可与无机化合物相媲美,被认为是最有前途的一类发光材料。下面是合成一种配体的路线,该产物与铜(Ⅱ)的配合物是一种可发蓝光的发光材料,在电致发光器材方面有很好的应用前景。
![]()
![]()
![]() 请写出(A)~(D)各化合物的结构式,如有立体结构请用符号表明。
请写出(A)~(D)各化合物的结构式,如有立体结构请用符号表明。
![]() A:___________________________________________________________
A:___________________________________________________________
![]() B:___________________________________________________________
B:___________________________________________________________
![]() C:___________________________________________________________
C:___________________________________________________________
![]() D:___________________________________________________________
D:___________________________________________________________
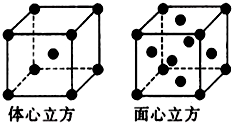
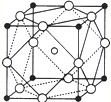 [化学--物质结构与性质
[化学--物质结构与性质 | 元素 | A | B | C | D |
| 性质 结构 信息 |
基态原子核外有两个电子层,最外层有3个未成对的电子 | 基态原子的M层有1对成对的p电子 | 基态原子核外电子排布为[Ar]3d104s2 | 有两种常见氧化物,其中有一种是冶金工业常用的还原剂 |
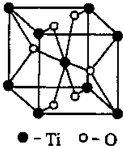 [化学-物质结构与性质]
[化学-物质结构与性质]湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com