
题目列表(包括答案和解析)

| c(CH3OH)?c(H2O) |
| c(CO2)?c3(H2) |
| c(CH3OH)?c(H2O) |
| c(CO2)?c3(H2) |
| 3 |
| 2 |
| 3 |
| 2 |
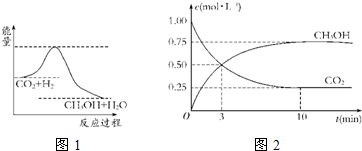
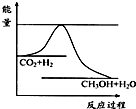 温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引起了各国的普遍重视.目前工业上有一种方法是用CO2生产燃料甲醇.一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),如图表示该反应进行过程中能量(单位为kJ?mol-1)的变化.
温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引起了各国的普遍重视.目前工业上有一种方法是用CO2生产燃料甲醇.一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),如图表示该反应进行过程中能量(单位为kJ?mol-1)的变化.| c(CH3OH)?c(H2O) |
| c(CO2)?c2(H2) |
| c(CH3OH)?c(H2O) |
| c(CO2)?c2(H2) |
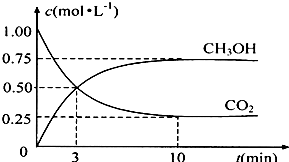
| n(CH3OH) |
| n(CO2) |

| c(CH3OH)?c(H2O) |
| c(CO2)?c3(H2) |
| c(CH3OH)?c(H2O) |
| c(CO2)?c3(H2) |
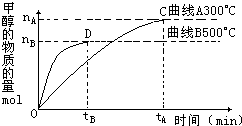 A.在300℃,从反应开始到平衡,甲醇的平均反应速率v(CH3OH)=
A.在300℃,从反应开始到平衡,甲醇的平均反应速率v(CH3OH)=| nA |
| tA |
| n(H2) |
| n(CH3OH) |
| 3 |
| 2 |
| 3 |
| 2 |
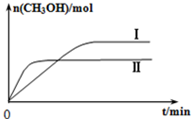 研究CO2的利用对促进低碳社会的构建具有重要的意义.
研究CO2的利用对促进低碳社会的构建具有重要的意义.| c(CH3OH)c(H2O) |
| c(CO2)c3(H2) |
| c(CH3OH)c(H2O) |
| c(CO2)c3(H2) |
| 容 器 | 甲 | 乙 |
| 反应物投入量 | 1molCO2、3molH2 | a molCO2、b molH2、 c molCH3OH(g)、c molH2O(g) |
| c(CH3OH)?c(H2O) |
| c(CO2)?c3(H2) |
| c(CH3OH)?c(H2O) |
| c(CO2)?c3(H2) |
第Ⅰ卷(选择题 共45分)
选择题 (1~15题,每题3分,共45分)
题 号
1
2
3
4
5
6
7
8
选 项
B
A
D
D
B
A
D
C
题 号
9
10
11
12
13
14
15
选 项
D
A
B
C
B
C
B
第Ⅱ卷(非选择题 共55分)
说明:1.合理答案均可酌情给分,但不得超过原题分数。
2.若化学方程式2分,不写条件扣1分,不配平扣1分。不写可逆符号扣1分,不得
负分。若化学方程1分,不写条件或不配平不得分。
3.除标注外,其余每空1分,不出现0.5分。
16.(共6分)
(1)4FeS2+11O2  2Fe2O3+8SO2
2Fe2O3+8SO2
(2)C
(3)A B(2分。多选、错选均不得分;选对一个且正确得1分)
(4)氨水 (NH4)2SO3+H2SO4  (NH4)2SO4+H2O+SO2↑(写出NH4HSO3也可)
(NH4)2SO4+H2O+SO2↑(写出NH4HSO3也可)
 17.(共7分)
17.(共7分)
(1)CH3CH2OH
CH2 CH2↑+ H2
O ①④⑤(多选、少选、错选均不
CH2↑+ H2
O ①④⑤(多选、少选、错选均不
得分)
 (2) 三角锥形 3Fe+8H++2NO
(2) 三角锥形 3Fe+8H++2NO
 3Fe2++2NO↑+4H2O
3Fe2++2NO↑+4H2O
(3)Al3+
+3AlO +6H2O
+6H2O  4Al(OH)
3↓ 2Al+2H2O+2OH
4Al(OH)
3↓ 2Al+2H2O+2OH
 2AlO
2AlO +3H2↑
+3H2↑
18.(共9分)
(1)2H2O2 2H2O+ O2↑
2H2O+ O2↑
(2)①③ (2分。多选、错选均不得分;选对一个且正确得1分)
(3)c(S2-)= [c(Na+)+c(H+)
[c(Na+)+c(H+) c (HS-)
c (HS-) c(OH
c(OH )]
)]
或c(S2-)= c (Na+)
c (Na+) c(HS
c(HS )
) c (H2S) (2分)
c (H2S) (2分)
(4)
19.(共8分)
(1)Fe3+、Al3+、Mg2+、H+(多写、少写、写错均不得分)
(2)SiO2+ Si+2CO↑
Si+2CO↑
AlO +CO2+ 2H2 O
+CO2+ 2H2 O  Al(OH)3↓+HCO
Al(OH)3↓+HCO (2分)
(2分)
(3)c d(2分。多选,错选均不得分;选对一个且正确得1分)
(4)电解 防止Mg2+水解,并带走水分,(答出“防止Mg2+水解”即可给分)
20.(共11分)
Ⅰ.(1)分液漏斗
B中棉花位置
①
②
③
④
所蘸试剂
现象
变红
褪色
体现的性质
还原性
(2)I2+SO2+2H2O
 4H+ +SO
4H+ +SO +2I
+2I
Ⅱ.(1)浓H2SO4
(2)Cl2+2I
 I2+2Cl
I2+2Cl b
b
(3)先由紫色变红色,后褪色
(4)5Cl2
+I2+6H2O  10Cl
10Cl +2IO
+2IO +12H+(2分)
+12H+(2分)
21.(共9分)
 |
22.(共5分)
(1)0.01 mol/L?s
(2)③④
(3)75%,<,
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com