
题目列表(包括答案和解析)
I.完成下列离子方程式(给出物质的计量数不能改变)
(1) +6H+=2Fe3++3
(2) +Ca2++2 =CaCO3↓+
II.常温下有浓度均为0.5mol/L的五种溶液:①NaHCO3;②C6H5ONa;③ NH4HCO3;④ NH3.H2O;⑤ HCl
(1)上述五种溶液中既能跟盐酸反应又能跟NaOH溶液反应的是 (填序号)。
(2)上述②的水溶液呈碱性的原因是(用离子方程式表示) 。
(3)③跟足量的NaOH浓溶液在加热条件下反应的离子方程式是
.
(4)加热④,溶液中的c(OH-)的变化有甲乙两种猜想,请设计实验探究证明
甲:c(OH-)将增大。升高温度有利于电离平衡移动,使氨水中c(OH-)增大。
乙:c(OH-)将减小。受热时温度升高氨气逸出,使c(OH-)减小
实验设计:
.
(5)取10mL溶液加水稀释到500mL,则该溶液中由水电离出的c(H+)=
mol/L. ![]()
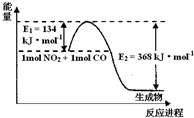 I.描述弱电解质电离情况可以用电离度和电离平衡常数表示,下表1是常温下几种弱酸的电离平衡常数(Ka)和弱碱的电离平衡常数(Kb).
I.描述弱电解质电离情况可以用电离度和电离平衡常数表示,下表1是常温下几种弱酸的电离平衡常数(Ka)和弱碱的电离平衡常数(Kb).| 酸或碱 | 电离平衡常数(Ka或 Kb) |
| CH3COOH | 1.8×10-5 |
| HNO2 | 4.6×10-4 |
| HCN | 5×10-10 |
| HClO | 3×10-8 |
| NH3?H2O | 1.8×10-5 |
| t/℃ | 200 | 300 | 400 |
| K | K1 | K2 | 0.5 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com