
题目列表(包括答案和解析)
| 时间(min) | 1 | 2 | 3 | 4 | 5 |
| 氢气体积(mL) | 30 | 120 | 280 | 350 | 370 |
 已知ClO4F的熔点为-167℃,沸点为-15.9℃,易分解或接触有机物发生爆炸;又知无水KF易吸收F2、HF和H2O;F2、HF、O2的沸点分别为-188℃、19.54℃、-183℃.李明采用特制的耐氟容器,使氟气缓缓地与一定浓度的HClO4反应来制取ClO4F,其实验装置如图所示,试回答:
已知ClO4F的熔点为-167℃,沸点为-15.9℃,易分解或接触有机物发生爆炸;又知无水KF易吸收F2、HF和H2O;F2、HF、O2的沸点分别为-188℃、19.54℃、-183℃.李明采用特制的耐氟容器,使氟气缓缓地与一定浓度的HClO4反应来制取ClO4F,其实验装置如图所示,试回答:在工业生产硫酸的过程中,发生如下反应:2SO2(g)+O2(g) 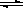 2SO3(g)+Q,下列叙述中,不正确的是:
2SO3(g)+Q,下列叙述中,不正确的是:
A.矿石粉碎的目的是使原料充分利用,并增大接触面使反应速率加快
B.接触室中采用常压的主要原因是常压下SO2的转化率已经很高
C.沸腾炉中出来的混合气需要洗涤,目的是防止催化剂中毒
D.接触室采用450℃的温度是使催化剂活性最佳,提高平衡混和气中SO3的含量
在工业生产硫酸的过程中,发生如下反应:2SO2(g)+O2(g) ![]() 2SO3(g)+Q,下列叙述中,不正确的是:
2SO3(g)+Q,下列叙述中,不正确的是:
A.矿石粉碎的目的是使原料充分利用,并增大接触面使反应速率加快
B.接触室中采用常压的主要原因是常压下SO2的转化率已经很高
C.沸腾炉中出来的混合气需要洗涤,目的是防止催化剂中毒
D.接触室采用450℃的温度是使催化剂活性最佳,提高平衡混和气中SO3的含量
在工业生产硫酸的过程中,发生如下反应:2SO2(g)+O2(g) ![]() 2SO3(g)+Q,下列叙述中,不正确的是:
2SO3(g)+Q,下列叙述中,不正确的是:
A.矿石粉碎的目的是使原料充分利用,并增大接触面使反应速率加快
B.接触室中采用常压的主要原因是常压下SO2的转化率已经很高
C.沸腾炉中出来的混合气需要洗涤,目的是防止催化剂中毒
D.接触室采用450℃的温度是使催化剂活性最佳,提高平衡混和气中SO3的含量
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com