
题目列表(包括答案和解析)
①25℃,难溶电解质的溶度积常数:Ksp[CaF2]=1.5×10-10,Ksp[Mg(OH)2]=1.8×10-11,Ksp [Cu(OH)2]=2.2×10-20
②弱电解质在水溶液中存在电离常数:例如一元弱酸HAH++A-,其电离常数表达式 Ka= c(H+)·c (A-)/ c (HA)(各浓度为平衡时浓度)。该常数与浓度、压强无关,只是温度的函数。25℃,醋酸的Ka=1.76×10-5
③25℃时,2.0×10-3mol·L-1氢氟酸水溶液中,调节溶液pH(忽略体积变化),得到
c(HF)、c(F-)与溶液pH的变化关系,如下图所示:
请根据以上信息回答下列问题:
(1)25℃时,向浓度均为0.1mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成__________沉淀(填化学式),生成该沉淀的离子方程式为 。
(2)25℃时,HF电离常数的数值Ka![]() ,列式并说明得出该常数的理由 。
,列式并说明得出该常数的理由 。
(3)25℃时,向浓度均为0.1mol·L-1的相同体积的HF和醋酸两种溶液中分别加入相同的足量锌粒,初始时产生氢气的速率关系为 (填“>”“=”或“<”,下同)。反应结束后,产生氢气的物质的量的关系为 ,两溶液中c (F-) c (CH3COO-)。
(4)25℃时,4.0×10-3mol·L-1HF溶液与4.0×10-4 mol·L-1 CaCl2溶液等体积混合,调节混合液pH为4.0(忽略调节混合液体积的变化),通过列式计算说明是否有沉淀产生。
已知几种难溶电解质的溶度积常数(25℃)见下表
|
| 难溶电解质 | AgCl | AgBr | AgI | Ag2SO4 | Ag2CrO4 |
| Ksp | 1.8×10-10 | 5.4×10-13 | 8.5×10-17 | 1.4×10-5 | 1.12×10-12 |
| A.Ksp的大小与三种卤化银见光分解的难易无关 |
| B.将等体积的4×10-3mo1?L-1的AgNO3和4×10-3mo1?L-1K2CrO4混合,有Ag2CrO4沉淀产生 |
| C.向AgCl的悬浊液中滴加NaI的饱和溶液可以得到黄色AgI悬浊液 |
| D.100mL0.1mol?L-1的Na2SO4溶液中加入1mL0.1mol?L-1的AgNO3溶液,有白色沉淀生成 |
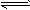 Fe2+(aq)+S2-(aq) ,Ksp = c(Fe2+)·c(S2-)=6.25×10-18 。溶液里各离子浓度幂的乘积,大于溶度积时则出现沉淀;反之沉淀溶解。试根据上述原理,计算:
Fe2+(aq)+S2-(aq) ,Ksp = c(Fe2+)·c(S2-)=6.25×10-18 。溶液里各离子浓度幂的乘积,大于溶度积时则出现沉淀;反之沉淀溶解。试根据上述原理,计算:
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com