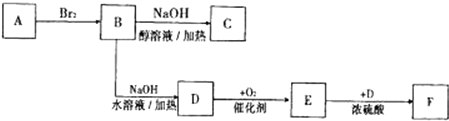
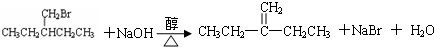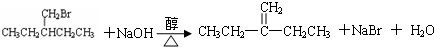垃圾是放错地方的资源,工业废料也可以再利用.某化学兴趣小组在实验室中用废弃含有铝、铁、铜的合金制取硫酸铝溶液、硝酸铜晶体和铁红(Fe
2O
3).其实验方案如下:

(1)请写出在合金中加入KOH溶液后所发生的离子反应方程式:
2Al+2OH-+2H2O=2AlO2-+3H2↑
2Al+2OH-+2H2O=2AlO2-+3H2↑
.
(2)在滤液A中直接加入硫酸所获得的硫酸铝溶液中会含有杂质(K
2SO
4),请设计一个更合理的实验方案由滤液A制备纯净的硫酸铝溶液.仿照上图形式画出制备流程图:(提示:在箭头上下方标出所用试剂或实验操作)

(3)已知Fe(OH)
3沉淀的pH是2~3.2.溶液C通过调节pH可以使Fe
3+沉淀完全.下列物质中,可用作调整溶液C的pH的试剂是
CD
CD
(填序号)
A.铜粉 B.氨水 C.氧化铜 D.氢氧化铜
(4)利用滤液D制取硝酸铜晶体,必须进行的实验操作步骤:加热蒸发、冷却结晶、
过滤
过滤
(填操作名称)、自然干燥.
(5)在0.1L的混合酸溶液中,c(HNO
3)=2mol?L
-1,c(H
2SO
4)=3mol?L
-1.将0.3mol的铜放入并充分反应后,产生的铜盐的化学式是
CuSO4
CuSO4
,被还原的n(HNO
3)=
0.2mol
0.2mol
.






 (1)在烷烃的系统命名法中甲基不能出现在1号位置,乙基能否出现在2号位置?
(1)在烷烃的系统命名法中甲基不能出现在1号位置,乙基能否出现在2号位置?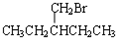 在一定条件下发生消去反应的方程式:
在一定条件下发生消去反应的方程式: