
题目列表(包括答案和解析)
把3体积NO2气体依次通过装有足量NaHCO3饱和溶液、浓H2SO4和Na2O2的3个装置,最后用排水法收集,假设氮的氧化物不与Na2O2反应,最后收集到_________________体积的气体,该气体的组成为________________。
解析:本题可采用规律法求解。因分子中氢原子数为4的烃,在相同条件下燃烧前后(水为气态)气体物质的量不变,压强相等。应用这一规律可得该烃的分子式可能为CH4、C2H4或C3H4。
| 催化剂 |
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)/×10-4mol?L-1 | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
| c(CO)/×10-3mol?L-1 | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
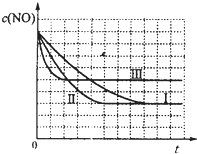
| 实验编号 | T/℃ | NO初始浓度/mol?L-1 | CO初始浓度/mol?L-1 | 催化剂的比表面积/m2?g-1 |
| ① | 350 | 1.20×10-2 | 5.80×10-2 | 124 |
| ② | 280 | 1.20×10-2 | 5.80×10-2 | 124 |
| ③ | 280 | 1.20×10-3 | 5.80×10-3 | 82 |
| NO | N2 | CO | |
| 起始浓度mol.L-1 | 0.10 | 0 | 0 |
| 平衡浓度/mol.L-1 | 0.04 | 0.03 | 0.03 |
| 判断依据 | 结论(写结构简式)) |
| 核磁共振氢谱有1个峰 | CH3OCH3 CH3OCH3 |
| 核磁共振氢谱有3个峰 | CH3CH2OH CH3CH2OH |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com