
题目列表(包括答案和解析)
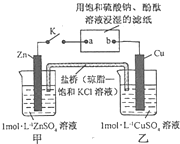 (2012?福建)将如图所示实验装置的K闭合,下列判断正确的是( )
(2012?福建)将如图所示实验装置的K闭合,下列判断正确的是( )| 压强(Pa) | 4×105 | 6×105 | 1×106 | 2×106 |
| D的浓度(mol/L) | 0.085 | 0.126 | 0.200 | 0.440 |
 (2011?杭州一模)氯化苄(C6H5CH2Cl)是一种重要的有机化工原料,广泛应用于医药、染料、助香料等有机化工产品的制备.氯化苄为无色液体,具有强烈的催泪作用,沸点为179.4℃,不溶于水,可混溶于乙醇、氯仿等多数有机溶剂.工业上采用甲苯与干燥氯气在光照条件下反应合成氯化苄.为探索不同光强条件对合成产率的影响,需要对不同光强条件下的粗产品进行纯度检测.每一组检测按照如下步骤进行:
(2011?杭州一模)氯化苄(C6H5CH2Cl)是一种重要的有机化工原料,广泛应用于医药、染料、助香料等有机化工产品的制备.氯化苄为无色液体,具有强烈的催泪作用,沸点为179.4℃,不溶于水,可混溶于乙醇、氯仿等多数有机溶剂.工业上采用甲苯与干燥氯气在光照条件下反应合成氯化苄.为探索不同光强条件对合成产率的影响,需要对不同光强条件下的粗产品进行纯度检测.每一组检测按照如下步骤进行: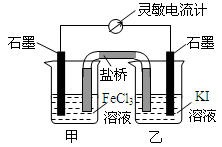 (2009?福建)控制适合的条件,将反应2Fe3++2I-?2Fe2++I2设计成如右图所示的原电池.下列判断不正确的是( )
(2009?福建)控制适合的条件,将反应2Fe3++2I-?2Fe2++I2设计成如右图所示的原电池.下列判断不正确的是( )
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com