
题目列表(包括答案和解析)
生物体中有许多含过渡金属离子的蛋白,其中有些金属蛋白在一定条件下能够吸收、释放氧气以供机体生命活动之需。这些天然载氧体的结构较复杂。研究发现,某些简单配合物也具有类似的载氧性质,可用作载氧体的模型化合物。研究较多的是钴(II)配合物。制备模型化合物的方法如下:水杨酸(邻羟基苯甲醛)和乙二胺在95%的乙醇溶液中反应,生成黄色晶体人通入氮气,加热,待黄色晶体溶解后,缓慢地加入醋酸钴,生成棕色沉淀。继续加热并搅拌,沉淀全部转变为暗红色B后,冷至室温,撤去氮气,滤出结晶,干燥之B是二聚体,在室温下稳定,不吸收氧气。但B在某些溶剂中可与溶剂L(如DMF或Py等)配位,并迅速吸收氧气形成暗黑色的分子氧加合物C。C在氯仿或苯中有细微气泡放出,并转变为暗红色。载氧试验结果: 360 mg样品B 在 15℃, 102.9kPa及饱和水蒸气压 1.2 kPa下,吸收 O2(设为理想气体) 12.90cm3。
3-1.写出A的化学式。
3-2.计算载氧试验中,Co 与被吸收氧气的物质的量之比。
3-3.画出C的结构示意图。
3-4.写出C在氯仿中的反应方程式。
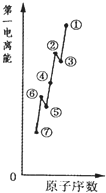
| 元素 | A | B | C | D |
| 性质 结构 信息 |
基态原子核外有两个电子层,最外层有3个未成对的电子 | 基态原子的M层有1对成对的p电子 | 基态原子核外电子排布为[Ar]3d104s2 | 有两种常见氧化物,其中有一种是冶金工业常用的还原剂 |
 物质结构的多样性让人类使用的材料精彩纷呈.
物质结构的多样性让人类使用的材料精彩纷呈.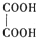 ,草酸钠晶体中存在
,草酸钠晶体中存在
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com