
题目列表(包括答案和解析)
(07年高考理综天津卷?7)2007年3月21日,我国公布了111号元素Rg的中文名称。该元素名称及所在周期是
A.钅仑 第七周期 B.镭 第七周期
C.铼 第六周期 D.氡 第六周期
(09广东卷).(分) 甲酸甲酯水解反应方程式为:
HCOOCH3(l)+H2O(l)![]() HCOOH(l)+CH3OH(l);△H>0
HCOOH(l)+CH3OH(l);△H>0
某小组通过试验研究该反应(反应过程中体积变化忽略不计)。反应体系中各组分的起始量如下表:
| 组分 | HCOOCH3 | H2O | HCOOH | CH3OH |
| 物质的量/mol | 1.00 | 1.99 | 0.01 | 0.52 |
甲酸甲酯转化率在温度T1下随反应时间(t)的变化如下图:

(1)根据上述条件,计算不同时间范围内甲酸甲酯的平均反应速率,结果见下表:
| 反应时间范围/min | 0~5 | 10~15 | 20~25 | 30~35 | 40~45 | 50~55 | 75~80 |
| 平均反应速率/(10-3mol·min-1) | 1.9 | 7.4 | 7.8 | 4.4 | 1.6 | 0.8 | 0.0 |
请计算15-20min范围内甲酸甲酯的减少量为 mol,甲酸甲酯的平均反应速率为 mol·min-1(不要求写出计算过程)。
(2)依据以上数据,写出该反应的反应速率在不同阶段的变化规律及其原因: 。
(3)上述反应的平衡常数表达式为:![]() ,则该反应在温度T1下的K值为 。
,则该反应在温度T1下的K值为 。
(4)其他条件不变,仅改变温度为T2(T2大于T1),在答题卡框图中画出温度T2下甲酸甲酯转化率随反应时间变化的预期结果示意图。
(09全国卷Ⅱ30)(15分) 化合物A相对分子质量为86,碳的质量分数为55.8%,氢为7.0%,其余为氧。A的相关反应如下图所示:
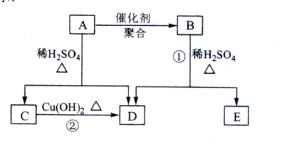
已知R-CH=CHOH(烯醇)不稳定,很快转化为![]() 。
。
根据以上信息回答下列问题:
![]() (1) A的分子式为 ;
(1) A的分子式为 ;
(2) 反应②的化学方程式是 ;
(3) A的结构简式是 ;
(4) 反应①的化学方程式是 ;
(5) A有多种同分异构体,写出四个同时满足(i)能发生水解反应(ii)能使溴的四氯化碳溶液褪色两个条件的同分异构体的结构简式: 、 、 、 ;
(6)A的另一种同分异构体,其分子中所有碳原子在一条直线上,它的结构简式为 。
(08年天津卷)(14分)W、X、Y、Z是原子序数依次增大的同一短同期元素,W、X是金属元素,Y、Z是非金属元素。
(1)W、X各自的最高价氧化物对应的水化物可以反应生盐和水,该反应的离子方程式为_____ 。
(2)W与Y 可形成化合物W2Y,该化合物的电子式为______ 。
(3)X的硝酸盐水溶液显 ___ 性,用离子方程式解释原因_____ 。
(4)Y的低价氧化物通入Z单质的水溶液中,发生反应的化学方程式为 ______ 。
(5)比较Y、Z气态氢化物的稳定性:_____ >_____ (用分子式表示)。
(6)W、X、Y、Z四种元素简单离子的离子半径由大到小的顺序是:___ > ____ >____ > ___ 。
(7)Z的最高价氧化物为无色液体,0.25 mol该物质与一定量水混合得到一种稀溶液,并放出QkJ的热量。写出该反应的热化学方程式:___________ 。
![]() (09宁夏卷).(分)碱式碳酸铜可表示为:xCuCO3·yCu(OH) 2·zH2O,测定碱式碳酸铜组成的方法有多种。
(09宁夏卷).(分)碱式碳酸铜可表示为:xCuCO3·yCu(OH) 2·zH2O,测定碱式碳酸铜组成的方法有多种。
(1)现采用氢气还原法,请回答如下问题:
①写出xCuCO3·yCu(OH) 2·zH2O与氢气反应的化学方程式 ;
②试验装置用下列所有仪器连接而成,按氢气流方向的连接顺序是(填入仪器接口字母编号):
 (a)→( )( )→( )( )→( )( )→( )( )→( )( )→(l)
(a)→( )( )→( )( )→( )( )→( )( )→( )( )→(l)
③称取23.9g某碱式碳酸铜样品,充分反应后得到12.7g残留物,生成4.4g二氧化碳和7.2g水。该样品的结晶水质量为 g,化学式为 ;
(2)某同学以氮气代替氢气,并用上述全部或部分仪器来测定碱式碳酸铜的组成,你认为是否可行?请说明理由。 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com