
题目列表(包括答案和解析)
(06年北京卷)X、Y、Z、W四种化合物均由短周期元素组成,其中X含有四种元素,X、Y、Z的焰色反应均为黄色,W为无色无味气体。这四种化合物具有下列转化关系(部分反应物、产物及反应条件已略去)。
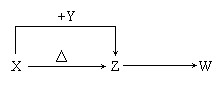
请回答:
(1)W的电子式是_______________________________________。
(2)X与Y在溶液中反应的离子方程式是______________________________。
(3)X含有的四种元素之间(二种、三种或四种)可组成多种化合物,选用其中某些化合物,利用下图装置(夹持固定装置已略去)进行实验,装置III中产生白色沉淀,装置V中可收集到一种无色气体。
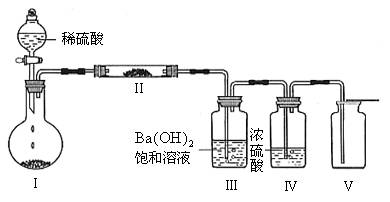
①装置I中反应的化学方程式是_______________________________________,装置II中物质的化学式是_____________________。
②用X含有的四种元素中的两种组成的某化合物,在催化剂存在下制备并收集纯净干燥的装置V中气体,该化合物的化学式是_______________,所需仪器装置是_____________(从上图选择必要装置,填写编号)。
(4)向Z溶液中通入氯气,可制得某种生产和生活中常用的漂白、消毒的物质,同时有X生成,该反应的化学方程式是_______________________________________。
(08年北京卷)(16分)菠萝酯是一种具有菠萝香气的食用香料,是化合物甲与苯氧乙酸![]() 发生酯化反应的产物。
发生酯化反应的产物。
⑴甲一定含有的官能团的名称是 。
⑵5.8g甲完全燃烧可产生0.3mol CO2和0.3 mol H2O,甲蒸气对氢气的相对密度是29,甲分子中不含甲基,且为链状结构,其结构简式是 。
⑶苯氧乙酸有多种酯类的同分异构体,其中能与FeCl3溶液发生显色反应,且有2种一硝基取代物的同分异构体是(写出任意2种的结构简式) 。
⑷已知:R-CH2-COOH![]()
![]()
R-ONa![]() R-O-R′(R-、R′-代表烃基)
R-O-R′(R-、R′-代表烃基)
菠萝酯的合成路线如下:

①试剂X不可选用的是(选填字母) 。
a. CH3COONa溶液 b. NaOH溶液 c. NaHCO3溶液 d.Na
②丙的结构简式是 ,反应II的反应类型是 。
③反应IV的化学方程式是 。
(09全国卷2,27)某温度时,在2L密闭容器中气态物质X和Y反应生成气态物质Z,它们的物质的量随时间的变化如表所示。
(1)根据表中数据,在图中画出X、Y、Z的物质的量(n)随时间(t)变化的曲线:
t/min | X/mol | Y/mol | Z/mol |
0 | 1.00 | 1.00 | 0.00 |
1 | 0.90 | 0.80 | 0.20 |
3 | 0.75 | 0.50 | 0.50 |
5 | 0.65 | 0.30 | 0.70 |
9 | 0.55 | 0.10 | 0.90 |
10 | 0.55 | 0.10 | 0.90 |
14 | 0.55 | 0.10 | 0.90 |

(2) 体系中发生反应的化学方程式是___________________________;
(3) 列式计算该反应在0-3min时间内产物Z的平均反应速率:_______________;
(4) 该反应达到平衡时反应物X的转化率![]() 等于___________________________;
等于___________________________;
(5) 如果该反应是放热反应。改变实验条件(温度、压强、催化剂)得到Z随时间变化的曲线①、②、③(如右图所示)则曲线①、②、③所对应的实验条件改变分别是:
① _________________ ②________________ ③__________________
(09宁夏卷)请回答氯碱的如下问题:
(1)氯气、烧碱是电解食盐水时按照固定的比率k(质量比)生成的产品。理论上k=_______(要求计算表达式和结果);
(2)原料粗盐中常含有泥沙和Ca2+、Mg2+、Fe3+、SO42-等杂质,必须精制后才能供电解使用。精制时,粗盐溶于水过滤后,还要加入的试剂分别为①Na2CO3、②HCl(盐酸)③BaCl2,这3种试剂添加的合理顺序是______________(填序号)
(3)氯碱工业是高耗能产业,一种将电解池与燃料电池相组合的新工艺可以节(电)能30%以上。在这种工艺设计中,相关物料的传输与转化关系如下图所示,其中的电极未标出,所用的离子膜都只允许阳离子通过。
① 图中X、Y分别是_____、_______(填化学式),分析比较图示中氢氧化钠质量分数a%与b%的大小_________;
图中X、Y分别是_____、_______(填化学式),分析比较图示中氢氧化钠质量分数a%与b%的大小_________;
②分别写出燃料电池B中正极、负极上发生的电极反应正极:______; 负极:_____;
③这样设计的主要节(电)能之处在于(写出2处)____________、____________。
(06年北京卷)铝和氢氧化钾都是重要的工业产品。请回答:
(1)工业冶炼铝的化学方程式是__________________________。
(2)铝与氢氧化钾溶液反应的离子方程式是__________________________。
(3)工业品氢氧化钾的溶液中含有某些含氧酸根杂质,可用离子交换膜法电解提纯。电解槽内装有阳离子交换膜(只允许阳离子通过),其工作原理如图所示。

①该电解槽的阳极反应式是__________________________。
②通电开始后,阴极附近溶液pH会增大,请简述原因____________________________
_______________________________________________________________________________________________________________________________________________。
③除去杂质后的氢氧化钾溶液从液化出口_____________(填写“A”或“B”)导出。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com