
题目列表(包括答案和解析)
(07年重庆卷)(14分)脱除天然气中的硫化氢既能减少环境污染,又可回收硫资源。
(1)硫化氢与FeCl3溶液反应生成单质硫,其离子方程式为 ________ 。
(2)用过量NaOH溶液吸收硫化氢后,以石墨作电极电解该溶液可回收硫、其电解总反应方程式(忽略氧的氧化还原)为 _____ ;该方法的优点是_________ 。
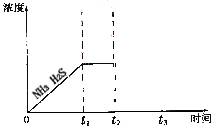
(3)一定温度下1 mol NH4 HS固体在定容真空容器中可部分分解为硫化氢和氨气。
①当反应达平衡时p氨气×p硫化氢=a(Pa2),则容器中的总压为 _____ Pa;
②题26图是上述反应过程中生成物浓度随时间变化的示意图。若t2时增大氨气的浓度且在t3时反应再次达到平衡,请在图上画出t2时刻后氨气、硫化氢的浓度随时间的变化曲线。
(06年重庆卷)为除去粗盐中的Ca2+、Mg2+、Fe3+、SO42― 以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
![]()
 (1)判断BaCl2已过量的方法是___________________________________
(1)判断BaCl2已过量的方法是___________________________________
__________________________________________________________________________________________________________________。
(2)第④步中,相关的离子方程式是______________________________
________________________________________________________。
(3)若先用盐酸调pH值再过滤,将对实验结果产生影响,其原因是
___________________________________________________________________________________________________________________。
(4)为检验精盐纯度,需配制150 mL.0.2 mol/L NaCl(精盐)溶液,题26图是该同学转移溶液的示意图,图中的错误是_________________
_________________________________________________________。
(06年重庆卷)为除去粗盐中的Ca2+、Mg2+、Fe3+、SO42― 以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
![]()
 (1)判断BaCl2已过量的方法是___________________________________
(1)判断BaCl2已过量的方法是___________________________________
__________________________________________________________________________________________________________________。
(2)第④步中,相关的离子方程式是______________________________
________________________________________________________。
(3)若先用盐酸调pH值再过滤,将对实验结果产生影响,其原因是
___________________________________________________________________________________________________________________。
(4)为检验精盐纯度,需配制150 mL.0.2 mol/L NaCl(精盐)溶液,题26图是该同学转移溶液的示意图,图中的错误是_________________
_________________________________________________________。
(08年重庆卷)(14分)N2O5―是一种新型硝化剂,其性质和制备受到人们的关注。
(1)N2O5与苯发生硝化反应生成的硝基苯的结构简式是:2N2O5(g)→4NO2(g)+O2(g);ΔH>0
①反应达平衡后,若再通入一定量氮气,则N2O5的转化率将 。(填“增大”、“减小”、“不变”)
②下表为反应在T1温度下的部分实验数据:
t/s | 0 | 500 | 1000 |
e(N2O5)/mol?L-1 | 5.00 | 3.52 | 2.48 |
则500 s内N2O5的分解速率为 。

③在T2温度下,反应1000 s时测得NO2的浓度为4.98 mol?L-1,则T1 T2.
(3)题26图所示装置可用于制备N2O5,则N2O5在电解池的 区生成,其电极反应式为 .
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com