
题目列表(包括答案和解析)
(1)A的化学式是____________,B的化学式是____________。
(2)写出下列反应的化学方程式:
①B煅烧生成C和D________________________________;
②G通入D溶液中__________________________________;
③向F中滴入溴水__________________________________。
(1)A的化学式是___________;B的化学式是___________。
(2)写出下列反应的化学方程式:
①B煅烧生成C和D:_________________________________;
②G通入D的溶液中:_________________________________;
③在F中滴入溴水:_________________________________;
④A和E反应:_________________________________。
(1)A的化学式是________,B的化学式是________。
(2)写出下列反应的化学方程式:
①B煅烧生成C和D________;
②C通入D的溶液中________;
③在F中滴入溴水________。
(3)写出A和E反应的离子方程式________。
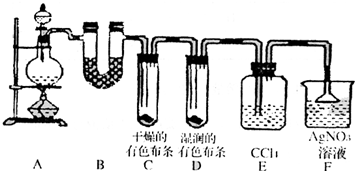 某校化学实验兴趣小组为了探究在实验室制备Cl2的过程中有水蒸气和HCl挥发出来,同时证明氯气的某些性质,甲同学设计了如下图所示的实验装置(支撑用的铁架台省略),按要求回答问题.
某校化学实验兴趣小组为了探究在实验室制备Cl2的过程中有水蒸气和HCl挥发出来,同时证明氯气的某些性质,甲同学设计了如下图所示的实验装置(支撑用的铁架台省略),按要求回答问题.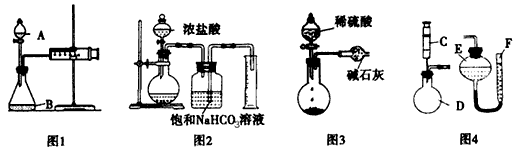
题号
1
2
3
4
5
6
7
8
9
答案
A
D
B
D
C
B
C
B
D
题号
10
11
12
13
14
15
16
17
18
答案
B
D
B
A
A
C
D
B
A
19.(1)CH3CH2OH+4H2SO4  4SO2↑+CO2↑+7H2O+C;
2分
4SO2↑+CO2↑+7H2O+C;
2分
(2)④→③→①→②; 1分
(3)品红褪色; 混合气中有SO2。 溴水颜色变浅;
将SO2吸收完全。 混合气中已无SO2。 每空1分
(4)无水CuSO4 , 饱和石灰水, 每空1分
20.(1)过滤
(2)Al2O3; K2SO4和(NH4)2SO4 每空1分
(3)②Al3++3NH3?H2O=Al(OH) 3↓+3NH4+
③NaAlO2+HCl+H2O=Al(OH) 3↓+NaCl 每空2分
21.
A. CH3 CH3
| |
CH3-C-CH2-C-CH3
| |
CH3 CH3
B1. CH3 CH3
| |
CH3-C-C-CH2-CH3
| |
CH3 CH3
B2. CH2CH3
|
CH3CH2-C-CH2CH3
|
CH2CH3
B3. CH3 CH3 CH3
| | |
CH3-CH-C -CH-CH3
| 每空2分
CH3
22.②③④⑤⑥ ④⑥ 每空2分
23.(1)BnAm 1分 (2)An- 1分 An-+H2O=HA(n-1)-+OH- 2分
24.(1)H2 , O2 , O2 + H2O + 4e- = 4OH- H2 ? 2e- + 2OH- = 2H2O; 每空1分
(2)O2 + 2H2O + 4e- = 4OH- , CH4 + 10OH- + 8e- = CO32- + 7H2O 每空1分
CH4 + 2KOH+ 2O2 = K2CO3 + 3H2O。 2分
25.Ⅰ(1) CH3COOH +OH-=CH3COO-+H2O。
(2) 0.1 (3) 大于 , 小于,小于
(4) c (CH3COO- ) >c (Na+) > c (H+)> c (OH ? ) 每空1分
 Ⅱ(1)CO32-+H2OHCO3-+OH-
Ⅱ(1)CO32-+H2OHCO3-+OH-
向纯碱溶液中滴加数滴酚酞试液后,溶液显红色;然后逐滴加入氯化钙溶液直至过量,若溶液红色逐渐变浅直至消失,则说明上述观点。
(2)用pH试纸(或pH计)测常温下0.1mol?L-1纯碱溶液的pH,若pH<12,则该同学
的观点正确;若pH>12,则该同学的观点不正确。
(3)B、D 每空1分
26.(1)12.4g 3分 (2)49.18% 2分
 w.w.w.k.s.5.u.c.o.m
w.w.w.k.s.5.u.c.o.m
www.ks5u.com
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com