
题目列表(包括答案和解析)
某粗盐中含有Ca2+、Mg2+、SO42-等杂质,现测定氯化钠含量。取120g粗盐溶于水过滤除去6g不溶物,向滤液中依次加入过量的下列试剂:1mol/L的氢氧化钠溶液200 mL、4.56g固体氯化钡、31.8%的碳酸钠溶液10g,发现白色沉淀逐渐增多,过滤除去沉淀物,再往滤液中加入过量的盐酸,使溶液呈酸性,加热蒸发得氯化钠晶体126.65g,则粗盐中含氯化钠的质量分数为
| A.94.1% | B.92.9% | C.86.3% | D.83.2% |
某粗盐中含有Ca2+、Mg2+、SO42-等杂质,现测定氯化钠含量。取120g粗盐溶于水过滤除去6g不溶物,向滤液中依次加入过量的下列试剂:1mol/L的氢氧化钠溶液200 mL、4.56g固体氯化钡、31.8%的碳酸钠溶液10g,发现白色沉淀逐渐增多,过滤除去沉淀物,再往滤液中加入过量的盐酸,使溶液呈酸性,加热蒸发得氯化钠晶体126.65g,则粗盐中含氯化钠的质量分数为
A.94.1% B.92.9% C.86.3% D.83.2%
| A.94.1% | B.92.9% | C.86.3% | D.83.2% |
|
粗盐中含有少量的Ca2+、Mg2+、SO42-等杂质,现采用①Na2CO3,②HCl,③Ba(OH)2来除杂,则这三种试剂添加的顺序是 | |
| [ ] | |
A. |
①②③ |
B. |
①③② |
C. |
③①② |
D. |
①③② |
粗盐中除了含有泥沙等不溶性杂质外,还含有CaCl2、MgCl2、Na2SO4等可溶性杂质,因此不宜直接食用,需要经过提纯得到精盐.某研究小组的同学对粗盐的提纯和检验进行研究,并提出一些新的方案.已知该粗盐样品中主要含有不溶性杂质、Mg2+、Ca2+,他们设计的流程如下:
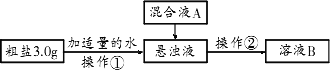
(1)操作①中需要使用的玻璃仪器有________、________.操作②的名称为________,若在操作②结束后发现溶液B略有浑浊,应采取的措施是________________;
(2)混合液A的主要成分是________;(填化学式)
(3)要将上述操作得到的精盐水进行蒸发,应有的操作是________________;
(4)对溶液B微热并不断滴加稀盐酸,同时用pH试纸检测溶液,直至溶液pH合适时停止加盐酸,得到溶液C.该操作的目的是________,将溶液C倒入________(填仪器名称)中,加热蒸发并用玻璃棒不断搅拌,直到________(填现象)时停止加热;
[问题讨论]
(5)在除杂过程中,向粗盐悬浊液中加混合液A时需要加热,目的是________;
(6)若某粗盐中还含有SO42-,能否仅用Ba(OH)2溶液、Na2CO3溶液除去食盐水中的可溶性杂质?________(填“能”或“不能”),如果达不到实验目的,需要如何改进?________,所加药品的顺序是________.
一、选择题:
题号
1
2
3
4
5
6
7
8
9
10
答案
D
A
D
C
D
D
D
B
C
B
题号
11
12
13
14
15
16
17
18
19
20
答案
D
C
C
D
B
D
C
A
C
B
题号
21
22
23
24
25
答案
A
C
A
D
C
二、填空题:
26.(6分)吸水性; 脱水性和强氧化性; 强氧化性; 强氧化性和酸性。
27.(6分)⑴Cl2+2OH-=ClO-+Cl-+H2O(2分)
⑵Cl2+H2O=HClO+HCl(2分) 次氯酸具有漂白作用,使衣服褪色。(2分)
28.(10分)
⑴A:Na F:FeCl2(各1分) ⑵自来水消毒或制造盐酸(1分,合理答案均可给分)
⑶KSCN溶液或NaOH溶液(1分) ⑷2Na+2H2O==2Na++2OH-+H2↑(2分)
⑸FeCl2+2NaOH==Fe(OH)2↓+2NaCl(2分)
4Fe(OH)2+O2+2H2O==4Fe(OH)3(2分)
29.(9分) ⑴ Br2 Fe3+(FeCl3、FeBr3) (各1分)
⑵
选用试剂
实验现象
第一种方法
C(1分)
有机层无色(1分)
第二种方法
D(1分)
溶液变红(1分)
第三种方法
B(1分)
立即产生红褐色沉淀(1分)
⑶ Fe2+ (1分)
三、实验题:
30.(11分)⑴排尽装置中的空气,防止生成的NO被氧化(2分)
⑵除去气流中的水蒸气(1分)
⑶瓶内出现红棕色(1分)
⑷打开K1、K2,再持续通入一段时间的氧气和氮气(2分)
⑸液态或固态四氧化二氮(1分) 在通风橱中从冰盐水中取出烧瓶,观察到烧瓶中液体(或固体)迅速消失,瓶中充满红棕色气体,证明烧瓶中物质是液态(或固态)N2O4(2分)
⑹C中圆底烧瓶在实验前后(增加)的质量(2分)
四、计算题:
31、(8分)解:因为:Fe3+ +3OH-=Fe(OH)3↓ , Al3+ +3OH-=Al(OH)3↓,
Al(OH)3+
根据物质的量比得:
b-a= n(Al3+)
解得:n(Fe3+)=(
∴c(Fe3+)=(4a/3-b)mol/
www.ks5u.com
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com