
题目列表(包括答案和解析)
在下列反应中,HCl作还原剂的是( )
| A.2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O |
| B.Zn+2HCl=ZnCl2+H2↑ |
| C.NaOH+HCl=NaCl+H2O |
| D.CuO+2HCl=CuCl2+H2O |
实验室里迅速制备少量氯气可利用以下反应:
2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O
此反应不需要加热,常温下就可以迅速进行,而且对盐酸的浓度要求不高。
(1)用单线桥法或双线桥法表示出该反应的电子转移情况。
(2)该反应中,氧化剂是_______,还原剂是_______,氧化产物是_______。(均填化学式)
(3)当电子转移的数目为6.02×1023时,生成的氯气在标准状况下的体积为 ,被氧化的Cl-的个数为__________________。
某校化学兴趣小组为制备消毒液(主要成分是NaClO),设计了下列装置,并查阅到下列资料:在加热情况下氯气和碱溶液能发生如下反应:
3Cl2 + 6OH﹣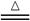 5Cl﹣+ ClO3﹣+3H2O
5Cl﹣+ ClO3﹣+3H2O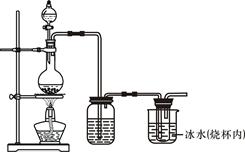
饱和食盐水 氢氧化钠溶液(试管内)
请回答下列问题:
(1)连接好装置,装药品之前,必须进行的一项操作步骤是________________。
(2)圆底烧瓶内发生反应的化学方程式为___________________________;大试管内发生反应的离子方程式为__________________________________________。
(3)饱和食盐水的作用是_______;冰水的作用是___________________。
(4)在制取Cl2时,实验室中若无MnO2,可用KMnO4粉末代替,发生下列反应:
2KMnO4+16HCl(浓)=2MnCl2+2KCl+5Cl2↑+8H2O, 则可选择的发生装置是(填序号)___________。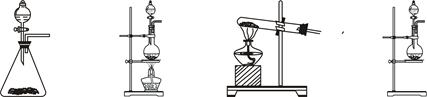
a、 b、 c、 d、
某校化学兴趣小组为制备消毒液(主要成分是NaClO),设计了下列装置,并查阅到下列资料:在加热情况下氯气和碱溶液能发生如下反应:
3Cl2 + 6OH﹣ 5Cl﹣+ ClO3﹣+3H2O
5Cl﹣+ ClO3﹣+3H2O
饱和食盐水 氢氧化钠溶液(试管内)
请回答下列问题:
(1)连接好装置,装药品之前,必须进行的一项操作步骤是________________。
(2)圆底烧瓶内发生反应的化学方程式为___________________________;大试管内发生反应的离子方程式为__________________________________________。
(3)饱和食盐水的作用是_______;冰水的作用是___________________。
(4)在制取Cl2时,实验室中若无MnO2,可用KMnO4粉末代替,发生下列反应:
2KMnO4+16HCl(浓)=2MnCl2+2KCl+5Cl2↑+8H2O,则可选择的发生装置是(填序号)___________。
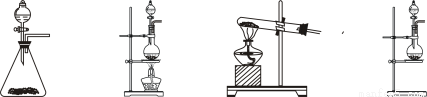
a、 b、 c、 d、
某课外活动小组利用如图所示装置制取氯气。提供的试剂有:浓盐酸、饱和食盐水、氢氧化钠溶液、高锰酸钾固体。反应的化学方程式为:
2KMnO4 + 16HCl(浓)= 2KCl + 2MnCl2 + 5Cl2↑+ 8H2O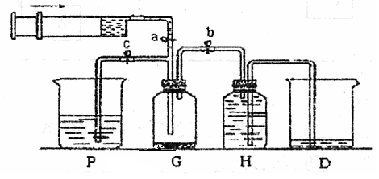
试回答下列问题:
(1)在反应2KMnO4 + 16HCl(浓)= 2KCl + 2MnCl2 + 5Cl2↑+ 8H2O中,HCl体现的性质为________和_________.当生成的Cl2的体积5.6L(标准状况下),求转移的电子的个数________(阿伏伽德罗常数用NA来表示)
(2)装置H中盛放的试剂是 。装置P中盛放的试剂是 。
(3)尾气处理时关闭弹簧夹a和弹簧夹 ,打开弹簧夹 。
(4)处理尾气时,发生反应的离子方程式为 。
一、选择题:(每小题3分,共60分)
1.C 2.C 3.B 4.A 5.B 6.B 7.C 8.C 9.D 10.D
11.B 12.C 13.C 14.C 15.A 16.C 17.D 18.D 19.C 20.D
 二、填空题(包括2小题,共14分)
二、填空题(包括2小题,共14分)
21、(每空2分,共8分)
 |
(1)
(2)FeCl3 (3)FeCl3 ==Fe3+ + 3 Cl- (4)AC
22、(共6分)H+、I―、Ba2+ ;CO 、SO
、SO ;K+(各1分)
;K+(各1分)
三、实验题(共8分)
23、(1)
(4)Cl2+2OH-=Cl―+ClO―+H2O(各2分)
四、推断题(共12分)
24、(1)(各1分) A:Na、 B :Al、 C :Fe、 乙:Cl2
(2)各(2分) 反应 ① 2Na + 2H2O = 2NaOH + H2 ↑
反应 ③ 2NaOH + 2H2O + 2 Al = 2NaAlO2 + 3H2 ↑
(3)各(2分 )反应 ④ Fe + 2H+ = Fe2+ + H2 ↑
反应 ⑥ Fe3+ + 3OH-= Fe(OH)3↓
五、计算题(共6分)
25、(1)2mol/L (2) 0.1mol(各3分)
 w.w.w.k.s.5.u.c.o.m
w.w.w.k.s.5.u.c.o.m
www.ks5u.com
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com