在锌与盐酸反应的实验中,甲同学得到的结果如表所示:
|
锌的质量(g) |
锌的形状 |
温度(℃) |
溶解于酸所需的时间(s) |
| A |
2 |
薄片 |
5 |
400 |
| B |
2 |
薄片 |
15 |
200 |
| C |
2 |
薄片 |
25 |
100 |
| D |
2 |
薄片 |
35 |
50 |
| E |
2 |
薄片 |
45 |
25 |
| F |
2 |
粉末 |
15 |
5 |
按要求回答下列问题:
(1)画出上述时间~温度曲线关系图(纵轴表示时间,横轴表示温度)

(2)温度对该反应速率的影响规律为
温度越高,反应速率越快
温度越高,反应速率越快
.
(3)对比结果B与F,F速率明显快的原因是
粉末状的锌粉与酸接触面积大,反应速率快
粉末状的锌粉与酸接触面积大,反应速率快
.
(4)乙同学将表面积相同、纯度相同、体积也相同的同种锌片分别投入等体积、浓度不同的稀硫酸和稀盐酸中(两酸中的氢离子浓度相同),仔细观察后发现,投入到稀硫酸中的锌表面产生的气泡没有投入到稀盐酸的快,产生这一现象可能的原因是:
硫酸根离子可能是这一反应的负催化剂而氯离子则可能是正催化剂
硫酸根离子可能是这一反应的负催化剂而氯离子则可能是正催化剂
.(只需回答一条即可)如何用实验来验证
向锌和稀硫酸反应中加氯化锌若反应速率加快则证明氯离子是正催化剂,向锌和稀盐酸反应中加硫酸锌溶液在反应中若反应速率慢则说明硫酸根离子是负催化剂
向锌和稀硫酸反应中加氯化锌若反应速率加快则证明氯离子是正催化剂,向锌和稀盐酸反应中加硫酸锌溶液在反应中若反应速率慢则说明硫酸根离子是负催化剂
.

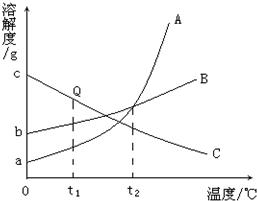 19、如图是A、B、C三种物质的溶解度曲线.
19、如图是A、B、C三种物质的溶解度曲线.