
题目列表(包括答案和解析)
(1)已知下列热化学方程式:
① H2(g)+1/2O2(g) =H2O(g) ΔH=-241.8 kJ/mol
② C(s)+1/2O2(g) =CO(g) ΔH=-110.5 kJ/moL
则水煤气能源的制取原理:C(s)+H2O(g)=H2(g)+CO (g) ΔH= kJ/moL
(2)下图表示化学反应体系中反应物、产物的能量和活化能的关系,符合甲图的方程式为( )符合乙图的方程式为( )(填写“A”、“B”、“C”、“D”选项)

A.CO(g)+H2O(g)=CO2(g)+H2(g) B.H2(g)+I2(g)=2HI(g)
C.H+(aq)+OH-(aq)=H2O D.CaCO3(s)=CaO(s)+CO2(g)
 (3)如图所示,若两池中均为Cu(NO3)2溶液,甲、乙两池电极材料都是铁棒和石墨棒,反应一段时间后请回答下列问题:
(3)如图所示,若两池中均为Cu(NO3)2溶液,甲、乙两池电极材料都是铁棒和石墨棒,反应一段时间后请回答下列问题:
①有红色物质析出的是甲池中的______棒,乙池中的_______棒。
②乙池中阳极的电极反应式是___________________________。
(4)已知25℃时AgCl的溶度积为1.77×10-10,则在AgCl的饱和溶液中c(Ag+)为 。(已知![]() =1.33)
=1.33)
下列热化学方程式中,△H能正确表示物质的燃烧热的是
A、 CO(g) +1/2O2(g) ==CO2(g); △H=-283.0 kJ/mol
B、 C(s) +1/2O2(g) ==CO(g); △H=-110.5 kJ/mol
C、 H2(g) +1/2O2(g)==H2O(g); △H=-241.8 kJ/mol
D、2C8H18(l) +25O2(g)==16CO2(g)+18H2O(l); △H=-11036 kJ/mol
氢气、碳、辛烷、甲烷的热化学方程式分别为:2H2(g)+O2(g)2H2O(l) ΔH=-571.6 kJ·mol-1 C(s)+1/2 O2(g)====CO(g) ΔH=-110.5 kJ·mol-1
C8H18(l)+25/2O2(g)====8CO2(g)+9H2O(l) ΔH=-5 518 kJ·mol-1
CH4(g)+2O2(g)====CO2(g)+2H2O(g) ΔH=-802.3 kJ·mol-1其中反应热能表示该物质燃烧热的是
A.氢气 B.碳 C.辛烷 D.甲烷
铁及其化合物在国民经济的发展中起着重要作用。

(1)已知:4Fe(s)+3O2(g)=2Fe2O3(s) △H=-1641.0kJ·mol-1 C(石墨)+1/2O2(g)=CO(g) △H=-110.5 kJ·mol-1则Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g)的△H= kJ·mol-1。
(2)铁在潮湿的空气中易发生电化学腐蚀。某同学将NaCl溶液滴在一块光亮清洁的铁板表面上,一段时间后发现液滴覆盖的圆周中心区(a)已被腐蚀而变暗,在液滴外沿形成棕色铁锈环(b),如图所示。液滴边缘是 区(填“正极”或“负极”),其电极反应式为 。
(3)铁钛合金是一种常用的不锈钢材料,某同学在探究该合金的性质时,往含有TiO2+、Fe3+溶液中加入铁屑至溶液显紫色,该过程中发生的反应有:
①2TiO2+(无色)+Fe+4H+=2Ti3+(紫色)+Fe2++2H2O
②Ti3+(紫色)+Fe3++H2O= TiO2+(无色)+Fe2++2H+
③ 。
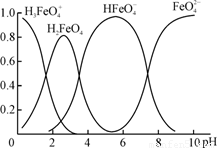
(4)①高铁酸钾(K2FeO4)是一种优良的水处理剂。FeO在水溶液中的存在形态如右图所示,纵坐标表示各存在形态的分数分布。
下列说法不正确的是 。(填字母)
A.不论溶液酸碱性如何变化,铁元素都有4种存在形态
B.向pH=10的这种溶液中加硫酸至pH=2,HFeO的分布分数逐渐增大
C.向pH=6的这种溶液中加KOH溶液,发生反应的离子方程式为:
HFeO+OH-=FeO+H2O
②K2FeO4溶于水会放出一种无色无味气体,其杀菌消毒、吸附水中的悬浮杂质的原理可用离子方程式表示为 。
(5)向一定量的Fe、FeO、Fe3O4的混合物中加入100 mL 1 mol·L-1的盐酸,恰好使混合物完全溶解,放出224 mL(标准状况)气体,加入KSCN溶液不显红色。若用足量的CO在高温下还原相同质量的此混合物,可得铁 g。
铁及其化合物在国民经济的发展中起着重要作用。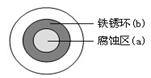
(1)已知:4Fe(s)+3O2(g)=2Fe2O3(s) △H=-1641.0kJ·mol-1 C(石墨)+1/2O2(g)=CO(g) △H=-110.5 kJ·mol-1则Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g)的△H= kJ·mol-1。
(2)铁在潮湿的空气中易发生电化学腐蚀。某同学将NaCl溶液滴在一块光亮清洁的铁板表面上,一段时间后发现液滴覆盖的圆周中心区(a)已被腐蚀而变暗,在液滴外沿形成棕色铁锈环(b),如图所示。液滴边缘是 区(填“正极”或“负极”),其电极反应式为 。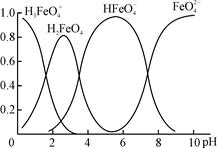
(3)铁钛合金是一种常用的不锈钢材料,某同学在探究该合金的性质时,往含有TiO2+、Fe3+溶液中加入铁屑至溶液显紫色,该过程中发生的反应有:
①2TiO2+(无色)+Fe+4H+=2Ti3+(紫色)+Fe2++2H2O
②Ti3+(紫色)+Fe3++H2O=TiO2+(无色)+Fe2++2H+
③ 。
(4)①高铁酸钾(K2FeO4)是一种优良的水处理剂。FeO在水溶液中的存在形态如右图所示,纵坐标表示各存在形态的分数分布。
下列说法不正确的是 。(填字母)
A.不论溶液酸碱性如何变化,铁元素都有4种存在形态
B.向pH=10的这种溶液中加硫酸至pH=2,HFeO的分布分数逐渐增大
C.向pH=6的这种溶液中加KOH溶液,发生反应的离子方程式为:
HFeO+OH-=FeO+H2O
②K2FeO4溶于水会放出一种无色无味气体,其杀菌消毒、吸附水中的悬浮杂质的原理可用离子方程式表示为 。
(5)向一定量的Fe、FeO、Fe3O4的混合物中加入100 mL 1 mol·L-1的盐酸,恰好使混合物完全溶解,放出224 mL(标准状况)气体,加入KSCN溶液不显红色。若用足量的CO在高温下还原相同质量的此混合物,可得铁 g。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com