
题目列表(包括答案和解析)
用单质硫与金属单质R在加热条件下可生成化合物M,如把![]() 溶液加入到R的硫酸盐溶液中,也可得到不溶性物质M,则R和M可能是
溶液加入到R的硫酸盐溶液中,也可得到不溶性物质M,则R和M可能是
[
]A
.Na、 短周期元素Q、R、T、W在元素周期表中的位置如右图所示,其中T所处的周期序数与主族序数相等,请回答下列问题:
短周期元素Q、R、T、W在元素周期表中的位置如右图所示,其中T所处的周期序数与主族序数相等,请回答下列问题:
| ||
| ||
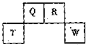 (2012?长宁区一模)短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等,请回答下列问题:
(2012?长宁区一模)短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等,请回答下列问题:

| ||
| ||
| ||
| ||
短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等,请回答下列问题:

1.T的离子结构示意图为________.
2.元素的非金属性为(原子的得电子能力):Q________W(填“强于”或“弱于”).
3.W的单质与其最高价氧化物的水化物浓溶液共热能发生反应,生成两种物质,其中一种是气体,反应的化学方程式为________.
4.原子序数比R多1的元素的一种氢化物能分解为它的另一种氢化物,此分解反应的化学方程式是________.
5.R有多种氧化物,其中甲的相对分子质量最小.在一定条件下,2 L的甲气体与0.5 L的氧气相混合,若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,所生成的R的含氧酸盐的化学式是________.
Ⅰ、磷、硫元素的单质和化合物应用广泛.
6.磷元素的原子核外电子排布式是________.
7.磷酸钙与焦炭、石英砂混合,在电炉中加热到1500℃生成白磷,反应为:
2Ca3(PO4)2+6SiO2→6CaSiO3+P4O10 10C+P4O10→P4+10CO
每生成1 mol P4时,就有________mol电子发生转移.
Ⅱ、稀土元素是宝贵的战略资源,我国的蕴藏量居世界首位.
8.铈(Ce)是地壳中含量最高的稀土元素.在加热条件下CeCl3易发生水解,无水CeCl3可用加热CeCl3·6H2O和NH4Cl固体混合物的方法来制备.其中NH4Cl的作用是________.
9.在某强酸性混合稀土溶液中加入H2O2,调节pH≈3,Ce3+通过下列反应形成Ce(OH)4沉淀得以分离.完成反应的离子方程式:
________Ce3++________H2O2+________H2O→________Ce(OH)4↓+________.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com