
题目列表(包括答案和解析)
|
在一定温度下,向V L体积固定的密闭容器中加入1 mol N2和3 mol H2,发生如下反应:N2+3H2 ①容器内压强不随时间变化而变化 ②混合气体的密度不随时间变化而变化 ③NH3的浓度不再变化 ④N2、H2、NH3的浓度之比为1∶3∶2 ⑤N2、H2的转化率相等 | |
| [ ] | |
A. |
①②③ |
B. |
②③⑤ |
C. |
①③ |
D. |
④⑤ |
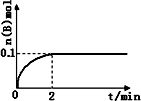
(1)在一定温度下,向1 L体积固定的密闭容器中加入1 mol A(g),发生反应2A(g)![]() B(g)+C(g),B的物质的量随时间的变化如图所示.0-2 min内的平均反应速率v(A)=________.相同温度下,若开始加入A(g)的物质的量是原来的2倍,则平衡时________是原来的2倍.
B(g)+C(g),B的物质的量随时间的变化如图所示.0-2 min内的平均反应速率v(A)=________.相同温度下,若开始加入A(g)的物质的量是原来的2倍,则平衡时________是原来的2倍.
a.平衡常数
b.A的平衡浓度
c.平衡时混合气体的密度
d.平衡时B的体积分数
(2)实验室用Zn和稀硫酸制取H2,反应时溶液中水的电离平衡________移动(填“向左”“向右”或“不”);若加入少量下列试剂中的________,产生H2的速率将增大.
a.NaNO3
b.CuSO4
c.Na2SO4
d.NaHSO3
e.CH3COOH
(3)用惰性电极电解Cu(NO3)2溶液一段时间后,加入a mol的Cu(OH)2可使溶液恢复原状,则电解过程中转移的电子数目为________.
(4)已知:2Zn(s)+O2(g)=2ZnO(s) ΔH=-701.0 kJ·mol-1
2Hg(l)+O2(g)=2HgO(s) ΔH=-181.6 kJ·mol-1
则反应Zn(s)+HgO(s)=ZnO(s)+Hg(l) ΔH=________
(5)已知25℃时,Ksp[Cu(OH)2]=2×10-20,要使0.2 mol·L-1 CuSO4溶液中Cu2+沉淀较为完全(使Cu2+浓度降至原来的千分之一),则应向溶液里加入NaOH溶液,使溶液的pH为________.
一定条件下,分别向容积固定的密闭容器中充入A和足量B,发生反应如下:2A(g)+B(s) 2D(g)△H<0,测得相关数据如下,分析可知下列说法不正确的是
2D(g)△H<0,测得相关数据如下,分析可知下列说法不正确的是
|
|
实验Ⅰ |
实验Ⅱ |
实验Ⅲ |
|
反应温度/℃ |
800 |
800 |
850 |
|
c(A)起始/mol·L-1 |
1 |
2 |
1 |
|
c(A)平衡/mol·L-1 |
.0.5 |
1 |
0.85 |
|
放出的热量/kJ |
a |
b |
c |
A.实验III的化学平衡常数K<1
B.实验放出的热量关系为b>2a
C.实验III在30min达到平衡时的速率v(A)为0.005mol• L-1·min-1
D.当容器内气体密度不随时间而变化时上述反应达到平衡
一定条件下,分别向容积固定的密闭容器中充入A和足量B,发生反应如下:2A(g)+B(s) 2D(g)△H<0,测得相关数据如下,分析可知下列说法不正确的是
2D(g)△H<0,测得相关数据如下,分析可知下列说法不正确的是
| | 实验Ⅰ | 实验Ⅱ | 实验Ⅲ |
| 反应温度/℃ | 800 | 800 | 850 |
| c(A)起始/mol·L-1 | 1 | 2 | 1 |
| c(A)平衡/mol·L-1 | .0.5 | 1 | 0.85 |
| 放出的热量/kJ | a | b | c |
 2D(g)△H<0,测得相关数据如下,分析可知下列说法不正确的是
2D(g)△H<0,测得相关数据如下,分析可知下列说法不正确的是| | 实验Ⅰ | 实验Ⅱ | 实验Ⅲ |
| 反应温度/℃ | 800 | 800 | 850 |
| c(A)起始/mol·L-1 | 1 | 2 | 1 |
| c(A)平衡/mol·L-1 | .0.5 | 1 | 0.85 |
| 放出的热量/kJ | a | b | c |
说明:
1. 本答案供阅卷评分使用,试题的参考解答是用来说明评分标准的,考生如按其他方法或步骤解答,正确的同样给分;有错的,根据错误的性质,参照评分标准中相应的规定评分。
2. 化学专用名词中出现错别字、元素符号有错误,都要参照评分标准扣分。
3. 化学方程式、离子方程式未配平的,都不给分。
4. 计算只有最后答案而无演算过程的,不给分。
第Ⅰ卷(选择题,共50分)
一、选择题(本题包括25小题,每小题2分,共50分。每小题只有一个选项符合题意)
1. A 2. D 3. B 4. A 5. C 6. D 7. C 8. C 9. D 10. D 11. B 12. C 13. B 14. D 15. A 16. D 17. A 18. C 19. A 20. B 21. B 22. D 23. B 24. C 25. A
第Ⅱ卷(非选择题,共50分)
二、(本题包括4小题,共22分)
26.(共4分)3,28,9,1,14(2分) 0.1(2分)
27.(共6分,每空2分)(1)0.01 mol/(L?s) (2)> 乙
 28.(共3分,每空1分)H2-2e-===2H+
H2+2OH--2e-===2H2O
28.(共3分,每空1分)H2-2e-===2H+
H2+2OH--2e-===2H2O
O2+2H2O+4e-===4OH-
29.(共9分,每空1分)(1)AlCl3 Al2O3 Fe
(2)铝热 焊接钢轨,冶炼钒、铬、锰等金属(答出一种即可)
(3)3Fe+4H2O高温====Fe3O4+4H2
(4)① 2Al+2OH-+2H2O===2AlO-2+3H2↑ ② Al3++3AlO-2+6H2O===4Al(OH)3↓
(5)氨水
三、(本题包括2小题,共15分)
30.(共7分)(1)I-、Fe2+、Al3+(3分) HCO-3、NO-3(2分)
(2)4Fe(OH)2+O2+2H2O===4Fe(OH)3(1分)
(3)AlO-2+CO2+2H2O===Al(OH)3↓+HCO-3(1分)
31.(共8分,每空1分)(1)Mg2++2OH-===Mg(OH)2↓(1分)
(2)碱式滴定管、酸式滴定管(1分) (3)酚酞(1分) 酚酞的变色范围最接近中性,滴定终点时,pH为8.2~10,Mg(OH)2不会溶解,不影响测定结果(1分)
(4)偏低(2分) (5)7.5 %(2分)
四、(本题包括2小题,共13分)
32.(共4分)解:n(Cu)==0.09 mol,n(HNO3)=2.0 mol/L×
==
3Cu+8HNO3(稀)===3Cu(NO3)2+2NO↑+4H2O ………………………………(1分)
3 8
=
因为< 所以硝酸过量 ……………………………………(1分)
n(NO)=×n(Cu)=×0.09 mol=0.06 mol ……………………………………(1分)
溶液中n(NO-3)=0.3 mol-0.06 mol=0.24 mol
c(NO-3)==1.6 mol/L ……………………………………………………(1分)
答:溶液中NO-3 的物质的量浓度为1.6 mol/L。
(此题的评分原则是:判断过量2分,算出NO-3 的浓度2分)
 33.(共9分)解:合金溶解于盐酸时所发生的反应有:
33.(共9分)解:合金溶解于盐酸时所发生的反应有:
Mg+2HCl===MgCl2+H2↑,2Al+6HCl===2AlCl3+3H2↑ ………………(1分)
根据图示,加NaOH溶液至130 mL过程中,发生的反应为:
NaOH+HCl===NaCl+H2O MgCl2+2NaOH===Mg(OH)2↓+2NaCl
AlCl3+3NaOH===Al(OH)3↓+3NaCl ………………………………………(1分)
当NaOH溶液由130 mL加至150 mL时,发生的反应为:
Al(OH)3+NaOH===NaAlO2+2H2O …………………………………………(1分)
(1)n(Mg)=n[Mg(OH)2]==0.15 mol ………………………………(1分)
m(Mg)=0.15 mol×
n(Al)=n[Al(OH)3]==0.1 mol ……………………………………(1分)
m(Al)=0.1 mol×
(2)据题意,在加入NaOH溶液130 mL时,溶液中n(Na+)=n(Cl-) …………(1分)
Na+ 全部来自NaOH,Cl- 全部来自盐酸,故n(HCl)=130×10
c(HCl)==6.5 mol/L …………………………………………………(1分)
答:原合金中Al、Mg的质量分别是
(此题的评分原则是:化学方程式或离子方程式共3分,算出铝的质量2分,算出镁的质量2分,算出盐酸的浓度2分。如未写化学方程式或离子方程式,计算结果正确者,镁、铝的质量各3分,盐酸的浓度3分)
 w.w.w.k.s.5.u.c.o.m
w.w.w.k.s.5.u.c.o.m
www.ks5u.com
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com