
题目列表(包括答案和解析)
下列溶液中各微粒的浓度关系一定正确的是( )
A.某酸性溶液中只含NH 、Cl-、H+、OH-四种离子,溶液中一定存在: 、Cl-、H+、OH-四种离子,溶液中一定存在:c(Cl-)>c(NH  )>c(H+)>c(OH-) )>c(H+)>c(OH-) |
| B.物质的量浓度相同的4种溶液:①CH3COONa;②NaNO3;③Na2CO3;④NaOH, pH的大小顺序是:④>③>①>② |
C.在Na2CO3和NaHCO3的混合溶液中:c(Na+)+c(H+)=c(HCO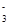 )+c(OH-)+c(CO )+c(OH-)+c(CO ) ) |
| D.25℃时,pH=10的CH3COONa溶液与pH=10的氨水中,由水电离出的c(OH-)之比为1∶1 |
(20分)(1) 25℃时,在酸性、碱性、中性溶液中,C(H+)·C(OH-)= 。
某温度下纯水中的C(H+)= 2×10-7mol/L,则此时溶液中的C(OH-)= mol/L;若温度不变,滴入稀盐酸,使c(H+)= 5×10-4mol/L,则溶液中C(OH-)= mol/ L,pH= .
L,pH= .
(2) 室温下取0.2 mol·L-1HCl溶液与0.2 mol·L-1 MOH溶液等体积混合(忽略混合后溶液 体积的变化),测得混合溶液的pH=6,试回答以下问题:
体积的变化),测得混合溶液的pH=6,试回答以下问题:
① 混合溶液中水电离出的c(H+)________0.2mol·L-1 HCl溶液中水电离出的c(H+);(填“>”、“<”、或“=”)
② 求出混合溶液中下列算式的精确计算结果(填具体数字):
c(Cl-)-c(M+)=__________ mol·L-1 c(H+)-c(MOH) =__________ mol·L-1
(3) 室温下如果取0.2 mol·L-1 MOH溶液与0.1 mol·L-1 HCl溶液等体积混合,测得混合溶液的pH<7,则说明MOH的电离程度________MCl的水解程度。(填“>”、“<”、或“=”),溶液中各离子浓度由大到小的顺序为_______________________。
(4)室温下,pH=13的强碱溶液与pH=2的强酸溶液混合,所得溶液的pH=7,则强碱与强酸的体积比是
下列溶液中各微粒的浓度关系一定正确的是( )
A.某酸性溶液中只含NH 、Cl-、H+、OH-四种离子,溶液中一定存在:
、Cl-、H+、OH-四种离子,溶液中一定存在:
c(Cl-)>c(NH )>c(H+)>c(OH-)
)>c(H+)>c(OH-)
B.物质的量浓度相同的4种溶液:①CH3COONa;②NaNO3;③Na2CO3;④NaOH,
pH的大小顺序是:④>③>①>②
C.在Na2CO3和NaHCO3的混合溶液中:c(Na+)+c(H+)=c(HCO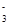 )+c(OH-)+c(CO
)+c(OH-)+c(CO )
)
D.25℃时,pH=10的CH3COONa溶液与pH=10的氨水中,由水电离出的c(OH-)之比为1∶1
已知在25℃时0.1mol/L醋酸溶液的pH约为3,向其中加入醋酸钠晶体,等晶体溶解后发现溶液的pH增大。对上述现象有两种不同的解释:甲同学认为醋酸钠水解呈碱性,增大了c(OH-),因而溶液的pH增大;乙同学认为醋酸钠溶于水电离出大量醋酸根离子,抑制了醋酸的电离,使c(H+)减小,因此溶液的pH增大。
(1)上述两种解释中 正确(填“甲”或“乙”)
(2)为了验证上述哪种解释正确,继续做如下实验:向0.1mol/L醋酸溶液中加入少量下列物质中的 (填写编号),然后测定溶液的pH。
A、固体CH3COOK B、固体CH3COONH4 C、气体NH3 D、固体NaHCO3
(3)若 (填“甲”或“乙”)的解释正确,溶液中的pH应 (填“增大”“减小”或“不变”)。
(4)常温下将0.010molCH3COONa和0.004molHCl溶于水,配制成0.5L混合溶液。判断:
①溶液中共有 种粒子。
②溶液中有两种粒子的物质的量之和一定等于0.010mol,它们是 。
③溶液中n(CH3COO-)+n(OH-)-n(H+)= mol。
A.某酸性溶液中只含NH 、Cl-、H+、OH-四种离子,溶液中一定存在: 、Cl-、H+、OH-四种离子,溶液中一定存在:c(Cl-)>c(NH  )>c(H+)>c(OH-) )>c(H+)>c(OH-) |
| B.物质的量浓度相同的4种溶液:①CH3COONa;②NaNO3;③Na2CO3;④NaOH, pH的大小顺序是:④>③>①>② |
C.在Na2CO3和NaHCO3的混合溶液中:c(Na+)+c(H+)=c(HCO )+c(OH-)+c(CO )+c(OH-)+c(CO ) ) |
| D.25℃时,pH=10的CH3COONa溶液与pH=10的氨水中,由水电离出的c(OH-)之比为1∶1 |
说明:
1. 本答案供阅卷评分使用,试题的参考解答是用来说明评分标准的,考生如按其他方法或步骤解答,正确的同样给分;有错的,根据错误的性质,参照评分标准中相应的规定评分。
2. 化学专用名词中出现错别字、元素符号有错误,都要参照评分标准扣分。
3. 化学方程式、离子方程式未配平的,都不给分。
4. 计算只有最后答案而无演算过程的,不给分。
第Ⅰ卷(选择题,共50分)
一、选择题(本题包括25小题,每小题2分,共50分。每小题只有一个选项符合题意)
1. D 2. B 3. C 4. D 5. B 6. D 7. C 8. A 9. A 10. C 11. C 12. B 13. B 14. A
15. D 16. D 17. B 18. A 19. A 20. C 21. C 22. A 23. B 24. C 25. D
第Ⅱ卷(非选择题,共50分)
二、填空题(本题包括6小题,每空1分,共25分)
26.(4分) > > 10-7 mol?L-1 10-14
27.(6分)2 失去2 3 FeS Fe+Cu2+===Fe2++Cu 2Fe+3Cl2点燃=====2FeCl3
28.(4分)→ ← ← ―
 29.(2分)正 氧化
29.(2分)正 氧化
 30.(5分)(1)Al 3 ⅢA (2)钠
30.(5分)(1)Al 3 ⅢA (2)钠
31.(4分)
三、简答题(本题包括3小题,共15分)
32.(共7分,每空1分)(1)2Al+Fe2O3高温=====2Fe+Al2O3 铝(或Al)
(2)大量气泡 2H2O2MnO2======2H2O+O2↑
(3)红 变深 增大任何一种反应物的浓度,都促使化学平衡向正反应方向移动
33.(共4分,每空1分)酸 Fe3++3H2O Fe(OH)3+3H+
盐酸(或HCl)
Fe(OH)3+3H+
盐酸(或HCl)
抑制Ag+ 的水解,防止溶液变浑浊
34.(共4分)(1)气体颜色加深(1分) 气体颜色变浅(1分) (2)升高温度,化学平衡向吸热反应方向移动;降低温度,平衡向放热反应方向移动(2分)
四、计算题(本题包括2小题,共10分)
 35. 解:HNO3+KOH===KNO3+H2O ……………………………………………(1分)
35. 解:HNO3+KOH===KNO3+H2O ……………………………………………(1分)
c(HNO3)?V[HNO3(aq)]=c(KOH)?V[KOH(aq)] ……………………………(1分)
c(HNO3)===0.5018 mol/L (2分)
答:这种HNO3溶液的物质的量浓度为0.5018 mol/L。
36. 解:合金粉末与过量的NaOH溶液混合,只有Al与NaOH反应。
2Al+2NaOH+2H2O===2NaAlO2+3H2↑ 
2×27 g
3×22.4 L
m(Al)
3.36 L …………………………………(2分)
m(Al)= =2.7 g ……………………………………………(2分)
=2.7 g ……………………………………………(2分)
合金中镁的质量分数w(Mg)=×100 %=32.5 % ………………(2分)
答:合金中镁的质量分数为32.5 % 。

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com