以下是分析硫铁矿中FeS
2含量的三种方法,各方法的操作流程图如下:
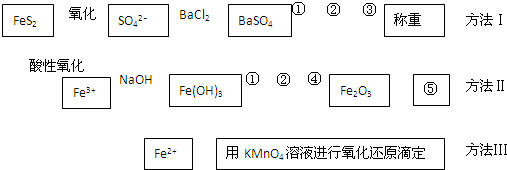
请回答下列问题:
(1)流程图中操作①、②、③分别指的是:①
过滤
过滤
、②
洗涤
洗涤
、③
干燥
干燥
.
操作④、⑤用到的主要仪器是:④
坩埚、酒精灯
坩埚、酒精灯
、⑤
天平
天平
(每空填1~2个仪器).
(2)判断溶液中SO
42-离子已沉淀完全的方法是
取上层清液滴加BaCl2溶液,若无白色沉淀生成,说明SO42-沉淀完全
取上层清液滴加BaCl2溶液,若无白色沉淀生成,说明SO42-沉淀完全
.
(3)某同学用方法Ⅲ测定试样中Fe元素的含量,准确称取一定量的矿石试样,试样经溶解、预处理后,
(A) 用带有刻度的烧杯配制成100 mL试样溶液
(B) 用量筒量取25.00 mL待测溶液
(C) 并置于锥形瓶中
(D) 用蒸馏水洗涤滴定管后装入KMnO
4标准溶液,用该标准溶液滴定待测试样,
(E) 当溶液变成淡紫红色时,停止滴定,如半分钟内不褪色,
(F) 读取并计算滴定管中消耗的KMnO
4标准溶液体积,计算试样中的Fe元素含量.
请指出该实验过程中错误操作步骤的编号:
A、B、D
A、B、D
.
(4)某同学采用方法Ⅱ分析矿石中的Fe含量,发现测定结果总是偏高,则产生误差的可能原因是
①Fe(OH)3沉淀表面积大,易吸附杂质;②过滤洗涤时未充分将吸附的杂质洗去;③Fe(OH)3灼烧不充分,未完全转化为Fe2O3
①Fe(OH)3沉淀表面积大,易吸附杂质;②过滤洗涤时未充分将吸附的杂质洗去;③Fe(OH)3灼烧不充分,未完全转化为Fe2O3
.
(5)称取矿石试样1.60g,按方法Ⅰ分析,称得BaSO
4的质量为4.66g,假设矿石中的硫元素全部来自于FeS
2,则该矿石中FeS
2的质量分数是
75.0%
75.0%
.

