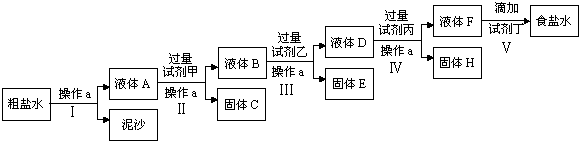
电解法制烧碱的原料是饱和食盐水,由于粗盐中含有泥沙和Ca
2+、Mg
2+、Fe
3+、SO
42- 杂质,不符合电解要求,因此必须经过精制.某校实验小组精制粗盐水的实验过程如下:

请回答以下问题:
(1)操作a的名称是
过滤
过滤
.
(2)在Ⅱ步中,加入过量试剂甲后,生成了两种大量的沉淀,则试剂甲为
NaOH
NaOH
溶液.试剂乙为
BaCl2
BaCl2
,固体F为
CaCO3和BaCO3
CaCO3和BaCO3
.
(3)在第Ⅴ步中,加入试剂丁直到溶液无明显变化时,写出此过程的化学方程式
NaOH+HCl=NaCl+H2O
NaOH+HCl=NaCl+H2O
、
Na2CO3+2HCl=2NaCl+H2O+CO2↑
Na2CO3+2HCl=2NaCl+H2O+CO2↑
.