
题目列表(包括答案和解析)
 硫及其化合物在自然界中广泛存在,运用相关原理回答下列问题:
硫及其化合物在自然界中广泛存在,运用相关原理回答下列问题: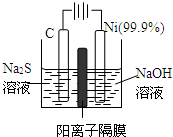
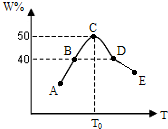 将5份物质的量均为2.0mol的X、Y混合,分别加入温度不同、容积相同(均为2L)的恒容容器中发生反应2X(g)+Y(g)?3W(g).经过相同时间10s时,五个容器中W的体积百分含量(W%)随温度(T)变化的关系如图.
将5份物质的量均为2.0mol的X、Y混合,分别加入温度不同、容积相同(均为2L)的恒容容器中发生反应2X(g)+Y(g)?3W(g).经过相同时间10s时,五个容器中W的体积百分含量(W%)随温度(T)变化的关系如图.硫及其化合物在自然界中广泛存在,运用相关
原理回答下列问题:
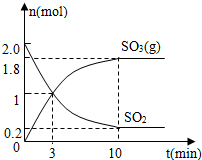
(1)如图表示一定温度下,向体积为10L的密闭容器中充入1molO2和一定量的SO2后,SO2和SO3(g)的浓度随时间变化的情况。
①该温度下,从反应开始至平衡时氧气的平均反应速率是 ;
②该温度下,反应2SO2(g)+O2(g) 2SO3(g)的平衡常数为 。
(2)以黄铜矿(主要成分CuFeS2)为原料,经焙烧、熔炼等使铁元素及其他有关杂质进入炉渣,将铜元素还原为铜。发生的主要反应为:
2Cu2S(s)+3O2(g) = 2Cu2O(s)+2SO2(g) △H =-768.2 kJ·mol-1
2Cu2O(s)+ Cu2S (s) = 6Cu(s)+SO2(g) △H =+116.0 kJ·mol-1
①“焙烧”时,通入少量空气使黄铜矿部分脱硫生成焙砂(主要成分是Cu2S和FeS,其物质的量比为1:2)和SO2,该反应的化学方程式为: 。
②在熔炼中,Cu2S与等物质的量的O2反应生成Cu的热化学方程式为: 。
(3)用电解的方法将硫化钠溶液氧化为多硫化物的研究具有重要的实际意义,将硫化物转变为多硫化物是电解法处理硫化氢废气的一个重要内容。
如图,是电解产生多硫化物的实验装置:
①已知阳极的反应为:(x+1)S2-=SxS2-+2xe-,则阴极的电极反应式是: 。
当反应转移xmol电子时,产生的气体体积为 (标准状况下)。
②将Na2S·9H2O溶于水中配制硫化物溶液时,通常是在氮气气氛下溶解。其原因是(用离子反应方程式表示): 。
硫磺在科学技术和生产中有重要的应用。石硫合剂是一种很好的植物杀虫剂,它是硫磺与石灰、水等反应所得――由多硫化钙[ CaSx(x≤5)]、硫代硫酸钙组成的混合物。不同比例的石灰和硫磺在水溶液中反应,可生成不同的多硫化钙和硫代硫酸钙。如:
3Ca(OH)2+8S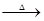 2CaS3+CaS2O3+3H2O;
2CaS3+CaS2O3+3H2O;
3Ca(OH)2+6S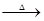 2CaS2+CaS2O3+3H2O等。
2CaS2+CaS2O3+3H2O等。
根据题意完成下列计算:
(1)、硫磺溶解在硫化钠溶液中生成一种多硫化物,该多硫化物中硫元素的质量分数为0.736,通过计算确定Na2Sx中x= 。
(2)、取某石硫合剂(假如只含两种含硫化合物)250mL(密度为1.12g/mL)通入足量CO2使其快速分解。原理如下:
Sx2-+2H2O+2CO2→(x-1)S↓+H2S↑+ 2HCO3-,S2O32- + H2O+CO2→HSO3-+HCO3-+S↓ 。
完全反应后共收集到气体1.12升(S·P·T)(忽略气体在溶液中的溶解),则该石硫合剂中多硫化钙的物质的量浓度为 ;硫代硫酸钙的质量分数为 。(答案用小数表示,保留2位有效数字)
(3)、如果把生石灰、硫磺和水按质量比7:16:70的配比完全反应后,只生成两种含硫的化合物,则该石硫合剂中多硫化钙与硫代硫酸钙的物质的量之比是 ;多硫化钙的化学式是 。
(4)、现有生石灰50.4g、硫磺96g、水504g恰好完全反应生成三种多硫化钙,除生成CaS4之外还有二种多硫化钙。请推算这二种多硫化钙可能的物质的量之比(写出推算过程)。
(1)如图所示,A是由导热材料制成的密闭容器,B是一耐化学腐蚀且易于传热的透明气囊。关闭K2,将各1 mol NO2通过K1、K3分别充入A、B中,反应起始时A、B的体积相同均为a L。
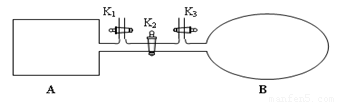
①B中可通过________________判断可逆反应2NO2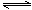 N2O4已经达到平衡。
N2O4已经达到平衡。
②若平衡后在A容器中再充入0.5mol N2O4,则重新到达平衡后,平衡混合气中NO2的体积分数_______________(填 “变大”“变小”或“不变”)。
③若容器A中到达平衡所需时间t s,达到平衡后容器内压强为起始压强的0.8倍,则平均化学反应速率v(NO2)等于____________________。
④若打开K2,平衡后B容器的体积缩至0.4a L,则打开K2之前,气球B体积为______L。
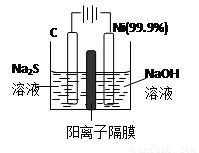
(2)用电解的方法将硫化钠溶液氧化为多硫化物的研究具有重要的实际意义,将硫化物转变为多硫化物是电解法处理硫化氢废气的一个重要内容。
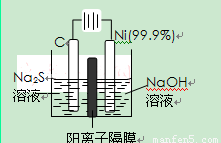
如图,是电解产生多硫化物的实验装置:
①已知阳极的反应为:(x+1)S2-=SxS2-+2xe-,
则阴极的电极反应式是: 。
当反应转移xmol电子时,产生的气体体积为 (标准状况下)。
②将Na2S·9H2O溶于水中配制硫化物溶液时,通常是在
氮气气氛下溶解。其原因是(用离子反应方程式表示): 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com