
题目列表(包括答案和解析)
| 甲 | 乙 | 丙 | |
| 分子 比例模型 |
 |
 |
 |
| 物质性质 | 地球上最常见的物质,是组成生物体的重要物质之一,约占人体质量的2/3. | 无色,无气味并且易燃.是常见的一种基础能源. | 有强氧化性的弱酸,可以用于消毒杀菌. |


| 甲 | 乙 | 丙 | |
| 分子 比例模型 | 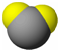 |  |  |
| 物质性质 | 地球上最常见的物质,是组成生物体的重要物质之一,约占人体质量的2/3. | 无色,无气味并且易燃.是常见的一种基础能源. | 有强氧化性的弱酸,可以用于消毒杀菌. |
| 甲 | 乙 | 丙 | |
| 分子 比例模型 | 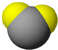 | 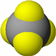 |  |
| 物质性质 | 地球上最常见的物质,是组成生物体的重要物质之一,约占人体质量的2/3. | 无色,无气味并且易燃.是常见的一种基础能源. | 有强氧化性的弱酸,可以用于消毒杀菌. |
| 甲 | 乙 | 丙 | |
| 分子 比例模型 |
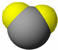 |
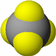 |
 |
| 物质性质 | 地球上最常见的物质,是组成生物体的重要物质之一,约占人体质量的2/3. | 无色,无气味并且易燃.是常见的一种基础能源. | 有强氧化性的弱酸,可以用于消毒杀菌. |
(10分)下表是元素周期表的一部分,表中字母分别代表某一化学元素,请回答有关问题。
(1)人们曾认为g、h、i不发生化学反应,因而把它们叫做稀有气体,但是后来发现这族气体可以参加化学反应,你认为g、h、i中最有可能首先被发现可以参加化学反应的元素是_______(写元素符号);g、h、i第一电离能由大到小的顺序为______。(用元素符号表示)
(2)e元素原子结构示意图为_____ __。d元素原子核外电子排布式为_____ __。
(3)a的阴离子半径__ __b的阳离子半径(填大于、等于、小于)。
(4)在元素周期表中有一个对角线规则,其中包括b、c的化合物的性质十分相似。则b的氯化物分别与少量和过量的氢氧化钠溶液发生反应的离子方程式分别为(要表达出具体的元素符号,下同)______ _______ __________;___________ ________________。
(5)f的+4价氧化物可与浓盐酸反应,且已知其氧化性强于氯气,则该氧化物与浓盐酸反应的化学方程式可表示为_____________ _________________________。
(6)元素周期表中第6周期中的镧系元素共有 种,它们原子的电子层结构和性质十分相似。
(7)元素k的氢化物乙可由两种10个电子的微粒组成的化合物甲(化学式X3Y2)与水剧烈反应能生成。甲与水反应的化学反应方程式为:____ ___。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com