
题目列表(包括答案和解析)
(12分)有一包含有碳酸钠杂质的碳酸氢钠样品。为了测定其纯度,某校同学在实验室进行如下实验。甲组实验方案:
在坩埚中称取样品3.0g →加热→冷却→称量→再加热•…(至恒重)。
①完成上述实验应该用到的玻璃仪器除酒精灯外还有____ ____。
②若坩埚质量为16.0g,加热至恒重时坩埚和残留物总质量为18.2g,则样品的纯度为 _
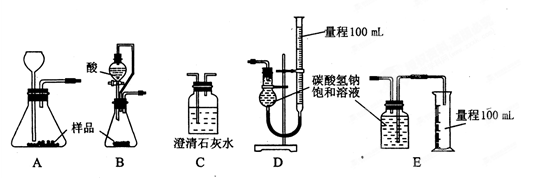
(1)乙组:称取样品,利用下面的部分装置测得室温下样品与酸反应放出CO2的体积,计算样品的纯度(已知碳酸钠、碳酸氢钠与酸的反应都是放热反应)。

①完成该实验方案应选择的最佳装置是 __(用字母回答,下同)。
②该实验应选用的酸是_ _
a.稀盐酸 b.稀硫酸 c.稀硝酸 d.三种酸均可。理由是________________________
(2) 丙组中A同学根据
 的反应设计了如下方案:称取样品→配成溶液→加入足量浓CaCl2溶液→充分反应后过滤→洗涤→干燥→称量→计算纯度。
的反应设计了如下方案:称取样品→配成溶液→加入足量浓CaCl2溶液→充分反应后过滤→洗涤→干燥→称量→计算纯度。
B同学对该实验方案提出质疑,丙组同学查阅了相关资料,并进行了如下实验:
室温下,取20 mL0.4 mol/L NaHCO3溶液置于烧杯中,向其中加入20 mL 2 mol/L CaCl2溶液,用玻璃棒搅拌。烧杯中出现白色沉淀,还有气泡产生。产生该现象的原因是_________ __ ___ (用有关离子方程式解释)。[来源:Z,xx,k.Com]
由此丙组同学共同讨论,否定了 A同学的设计方案。
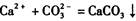 的反应设计了如下方案:称取样品→配成溶液→加入足量浓CaCl2溶液→充分反应后过滤→洗涤→干燥→称量→计算纯度。
的反应设计了如下方案:称取样品→配成溶液→加入足量浓CaCl2溶液→充分反应后过滤→洗涤→干燥→称量→计算纯度。(12分)有一包含有碳酸钠杂质的碳酸氢钠样品。为了测定其纯度,某校同学在实验室进行如下实验。甲组实验方案:
在坩埚中称取样品3.0g→加热→冷却→称量→再加热•…(至恒重)。
①完成上述实验应该用到的玻璃仪器除酒精灯外还有____ ____。
②若坩埚质量为16.0g,加热至恒重时坩埚和残留物总质量为18.2g,则样品的纯度为 _
(1)乙组:称取样品,利用下面的部分装置测得室温下样品与酸反应放出CO2的体积,计算样品的纯度(已知碳酸钠、碳酸氢钠与酸的反应都是放热反应)。
①完成该实验方案应选择的最佳装置是 __(用字母回答,下同)。
②该实验应选用的酸是_ _
a.稀盐酸 b.稀硫酸 c.稀硝酸 d.三种酸均可。理由是________________________
(2) 丙组中A同学根据的反应设计了如下方案:称取样品→配成溶液→加入足量浓CaCl2溶液→充分反应后过滤→洗涤→干燥→称量→计算纯度。
B同学对该实验方案提出质疑,丙组同学查阅了相关资料,并进行了如下实验:
室温下,取20 mL0.4 mol/L NaHCO3溶液置于烧杯中,向其中加入20 mL 2 mol/L CaCl2溶液,用玻璃棒搅拌。烧杯中出现白色沉淀,还有气泡产生。产生该现象的原因是___________ ___ (用有关离子方程式解释)。
由此丙组同学共同讨论,否定了 A同学的设计方案。
(12分)有一包含有碳酸钠杂质的碳酸氢钠样品。为了测定其纯度,某校同学在实验室进行如下实验。甲组实验方案:
在坩埚中称取样品3.0g →加热→冷却→称量→再加热?…(至恒重)。
①完成上述实验应该用到的玻璃仪器除酒精灯外还有____ ____。
②若坩埚质量为16.0g,加热至恒重时坩埚和残留物总质量为18.2g,则样品的纯度为 _
(1)乙组:称取样品,利用下面的部分装置测得室温下样品与酸反应放出CO2的体积,计算样品的纯度(已知碳酸钠、碳酸氢钠与酸的反应都是放热反应)。
①完成该实验方案应选择的最佳装置是 __(用字母回答,下同)。
②该实验应选用的酸是_ _
a.稀盐酸b.稀硫酸c.稀硝酸d.三种酸均可。理由是________________________
(2) 丙组中A同学根据 的反应设计了如下方案:称取样品→配成溶液→加入足量浓CaCl2溶液→充分反应后过滤→洗涤→干燥→称量→计算纯度。
的反应设计了如下方案:称取样品→配成溶液→加入足量浓CaCl2溶液→充分反应后过滤→洗涤→干燥→称量→计算纯度。
B同学对该实验方案提出质疑,丙组同学查阅了相关资料,并进行了如下实验:
室温下,取20 mL0.4 mol/L NaHCO3溶液置于烧杯中,向其中加入20 mL 2 mol/L CaCl2溶液,用玻璃棒搅拌。烧杯中出现白色沉淀,还有气泡产生。产生该现象的原因是_________ __ ___ (用有关离子方程式解释)。[来源:Z,xx,k.Com]
由此丙组同学共同讨论,否定了A同学的设计方案。
(1)为测定某地空气中SO2和可吸入颗粒的含量,甲同学设计了如下图所示的实验装置:

①应用上述装置测定空气中的SO2含量和可吸入颗粒的含量,除测定气体流速(单位:cm3/min)外,还需要测定_________________。
②已知:碘单质微溶于水,KI可以增大碘在水中的溶解度。
请你协助同学完成100 mL 5×10-4 mol·L-1碘溶液的配制:
第一步:准确称取1.27 g碘单质加入烧杯中,________________;
第二步:______________________________________________________________;
第三步:从第二步所得溶液中,取出10.00 mL溶液于100 mL容量瓶中,加水稀释至刻度线。

(2)乙同学拟用下列简易装置测定空气中的SO2含量:准确移取50 mL 5×10-4mol·L-1的碘溶液,注入上图所示广口瓶中,加2—3滴淀粉指示剂,此时溶液呈蓝色。在指定的测定地点抽气,每次抽气100 mL,直到溶液的蓝色全部褪尽为止,记录抽气次数(n)。
①假设乙同学的测量是准确的,抽气次数至少为_____次,方可说明该地空气中排放的SO2含量符合标准。
②如果乙同学用该方法测量空气中SO2的含量时,所测得的数值比实际含量低,请你对其可能的原因(假设溶液配制、称量或量取及各种读数均无错误)提出合理假设:
_____________________________________________________________________。
③丙同学认为:乙同学的实验方案抽气次数太多,操作麻烦。与乙讨论后,决定将抽气次数降到100次以下,请你设计合理的改进方案:_______________________________________。
(3)改变合适的吸收液,乙同学使用的装置还可以测定新装修的居室空气中甲醛的浓度,吸收剂最好选用______________(选填a.浓硫酸 b.银氨溶液 c.新制的氢氧化铜 d.酸化的高锰酸钾溶液)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com