
题目列表(包括答案和解析)
等物质的量的下列金属与对应物质的量浓度的酸发生反应,则反应刚开始时,产生氢气速率最快的是
|
编号 |
金属(粉末状) |
酸浓度 |
酸体积 |
反应温度 |
|
A |
铝Al |
18.4mol/L硫酸 |
300mL |
100℃ |
|
B |
铜Cu |
6 mol/L硝酸 |
300mL |
80℃ |
|
C |
镁Mg |
3 mol/L硫酸 |
300mL |
50℃ |
|
D |
锌Zn |
6 mol/L盐酸 |
300mL |
50℃ |
| 等物质的量的下列金属与对应物质的量浓度的酸发生反应,则反应刚开始时,产生氢气速率最快的是 | |||||||||||||||||||||||||
|
[ ] | |||||||||||||||||||||||||
|
等物质的量的下列金属与对应物质的量浓度的酸发生反应,则反应刚开始时,产生氢气速率最快的是
| 编号 | 金属(粉末状) | 酸浓度 | 酸体积 | 反应温度 |
| A | 铝Al | 18.4mol/L硫酸 | 300mL | 100℃ |
| B | 铜Cu | 6 mol/L硝酸 | 300mL | 80℃ |
| C | 镁Mg | 3 mol/L硫酸 | 300mL | 50℃ |
| D | 锌Zn | 6 mol/L盐酸 | 300mL | 50℃ |
Cu的化合物在生活及科研中有重要作用,不同反应可制得不同状态的Cu2O
(1)科学研究发现纳米级的Cu2O可作为太阳光分解水的催化剂。
①在加热条件下用液态肼(N2H4)还原新制Cu(OH)2可制备纳米级Cu2O,同时放出N2。当收集的N2体积为3.36L(已换算为标准状况)时,可制备纳米级Cu2O的质量为 ;
②一定温度下,在2 L密闭容器中加入纳米级Cu2O并通入0.20 mol水蒸气,发生反应:
;测得20 min时O2的物质的量为0.0016 mol,则前20 min的反应速率v(H2O)= ;该温度下,反应的平衡常数表达式K= ;下图表示在t1时刻达到平衡后,只改变一个条件又达到平衡的不同时段内,H2的浓度随时间变化的情况,则t1时平衡的移动方向为 ,t2时改变的条件可能为 ;若以K1、K2、K3分别表示t1时刻起改变条件的三个时间段内的平衡常数,t3时刻没有加入或减少体系中的任何物质,则K1、K2、K3的关系为 ;
(2)已知:ΔH=-293kJ·mol-1
ΔH=-221kJ·mol-1
请写出用足量炭粉还原CuO(s)制备Cu2O(s)的热化学方程式 ;
(3)用电解法也可制备Cu2O。原理如右上图所示,则阳极电极反应可以表示为 。
Cu的化合物在生活及科研中有重要作用,不同反应可制得不同状态的Cu2O
(1)科学研究发现纳米级的Cu2O可作为太阳光分解水的催化剂。
①在加热条件下用液态肼(N2H4)还原新制Cu(OH)2可制备纳米级Cu2O,同时放出N2。当收集的N2体积为3.36L(已换算为标准状况)时,可制备纳米级Cu2O的质量为 ;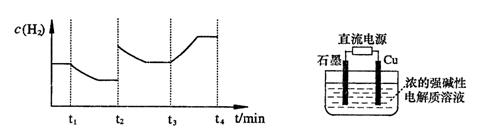
②一定 温度下,在2 L密闭容器中加入纳米级Cu2O并通入0.20 mol水蒸气,发生反应:
温度下,在2 L密闭容器中加入纳米级Cu2O并通入0.20 mol水蒸气,发生反应:
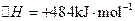 ;测得20 min时O2的物质的量为0.0016 mol,则前20 min的反应速率v(H2O)= ;该温度下,反应的平衡常数表达式K= ;下图表示在t1时刻达到平衡后,只改变一个条件又达到平衡的不同时段内,H2的浓度随时间变化的情况,则t1时平衡的移动方向为 ,t2时改变的条件可能为 ;若以K1、K2、K3分别表示t1时刻起改变条件的三个时间段内的平
;测得20 min时O2的物质的量为0.0016 mol,则前20 min的反应速率v(H2O)= ;该温度下,反应的平衡常数表达式K= ;下图表示在t1时刻达到平衡后,只改变一个条件又达到平衡的不同时段内,H2的浓度随时间变化的情况,则t1时平衡的移动方向为 ,t2时改变的条件可能为 ;若以K1、K2、K3分别表示t1时刻起改变条件的三个时间段内的平 衡常数,t3时刻没有加入或减少体系中的任何物质,则K1、K2、K3的关系为 ;
衡常数,t3时刻没有加入或减少体系中的任何物质,则K1、K2、K3的关系为 ;
(2)已知: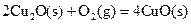 ΔH=-293kJ·mol-1
ΔH=-293kJ·mol-1 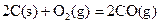 ΔH=-221kJ·mol-1
ΔH=-221kJ·mol-1
请写出用足量炭粉还原CuO(s)制备Cu2O(s)的热化学方程式 ;
(3)用电解法也可制备Cu2O。原理如右上图所示,则阳极电极反应可以表示为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com