
题目列表(包括答案和解析)
(1)最初加入的50 mL NaOH溶液的作用是什么?
答:________________________。
(2)画出沉淀量(m)随NaOH溶液体积滴入量的变化关系,并计算所用硫酸的浓度。
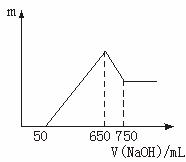
(3)试判断两种氧化物各是什么,并计算其物质的量。
计算题(共10分)
实验室常用的某盐酸试剂瓶的标签上的有关数据如下图,试根据标签上的
有关数据进行计算:
(1)计算该浓盐酸中HCl的
物质的量浓度。
(2)计算欲配制480ml 0.20mol/L的
稀盐酸溶液,需要取上述浓盐酸的体积。
(3)实验室用上述浓盐酸与二氧化锰
反应制取氯气,若制得0.56L
(标准状况)氯气,计算被氧化的 HCl的物质的量及转移电子的物质的量。
计算题(共10分)
实验室常用的某盐酸试剂瓶的标签上的有关数据如下图,试根据标签上的
有关数据进行计算:
(1)计算该浓盐酸中HCl的
物质的量浓度。
( 2)计算欲配制480ml 0.20mol/L的
2)计算欲配制480ml 0.20mol/L的
稀盐酸溶液,需要取上述浓盐酸的体积。
(3)实验室用上述浓盐酸与二氧化锰
反应制取氯气,若制得0.56L
(标准状况)氯气,计算被氧化的 HCl的物质的量及转移电子的物质的量。
计算题(共10分)
实验室常用的某盐酸试剂瓶的标签上的有关数据如下图,试根据标签上的
有关数据进行计算:

(1)计算该浓盐酸中HCl的
物质的量浓度。
(2)计算欲配制480ml 0.20mol/L的
稀盐酸溶液,需要取上述浓盐酸的体积。
(3)实验室用上述浓盐酸与二氧化锰
反应制取氯气,若制得0.56L
(标准状况)氯气,计算被氧化的 HCl的物质的量及转移电子的物质的量。
 2(t-BuNO).
2(t-BuNO).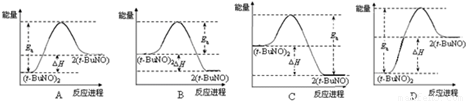
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com