
题目列表(包括答案和解析)

| ||
| ||
| ||
| ||

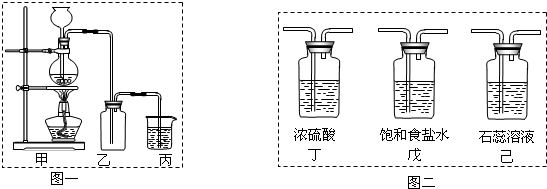
氯气是一种重要的化工原料,自来水的消毒、农药的生产、药物的合成等都需要用到氯气。某化学兴趣小组欲采用图一装置制取氯气,并探究氯气的性质。

图一
(1)指出图一装置中的错误之处
(2)C装置中发生反应的离子方程式 。
(3)为了制得干燥纯净的Cl2,请你结合图二将以上装置重新排序(可不选全): 。
(4)如果实验室中MnO2用完了,则下列物质可能可以用来代替MnO2制Cl2的是 。
A.NaBiO3 B.FeCl3 C.PbO2 D.Na2O2
已知氧化性强弱顺序为:NaBiO3>PbO2>MnO2>Na2O2>FeCl3
(5)为证明氯气的强氧化性,有同学将图一中的“B”换成“F”,你认为他这样做对吗?
。为什么? 。
(15分)氯气是一种重要的化工原料,自来水的消毒、农药的生产、药物的合成等都需要用到氯气。工业上通常采用电解法制氯气,其反应原理为:(用化学方程式表示) ▲ 。
某化学兴趣小组欲采用图一装置制取氯气,并探究氯气的性质。
(1)指出图一装置中的错误之处 ▲ , ▲
(2)丙装置的作用 ▲ 。丙装置中发生反应的离子方程式 ▲ 。
(3)为了制得干燥纯净的Cl2,请你结合图二将以上装置重新排序: ▲ 。
(4)如果实验室中MnO2用完了,则下列物质可能可以用来代替MnO2制Cl2的是:
▲ 。
A.NaBiO3 B.FeCl3 C.PbO2 D.Na2O2
已知氧化性强弱顺序为:NaBiO3>PbO2>MnO2>Na2O2>FeCl3
(5)为证明氯气的强氧化性,有同学将图一中的“乙”换成“己”,你认为他这样做对吗?
▲ 。为什么? ▲ 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com