
题目列表(包括答案和解析)
组成生命细胞的11种宏量元素(约占人体总质量的99.97%),全部位于周期表的前20号。其中组成人体蛋白质、脂肪、碳水化合物和核酸的主要有6种元素。
(1)这六种元素中除H、C、O、P、S外,应该还有______(写元素符号),它的原子最外层共有______种不同运动状态的电子;与它同周期,且单质熔点最高的元素在周期表中的位置_______________________。
(2)糖类是人体获得能量的来源之一。已知1mol 葡萄糖在人体内完全氧化为二氧化碳和水,放出2804 kJ的热量,该反应的热化学方程式_______________________________________。
(3)CO2是一种温室气体,它的电子式为______________,将其转变其他化工原料,必须破坏的化学键属于_________(填“极性”或“非极性”)键。
(4)元素周期表中元素的性质存在递变规律,下列关系正确的是______(填序号)。
a.离子半径:S2—>Na+>O2—>H+ b.与水反应的剧烈程度:K>Na>Mg>Ca
c.熔点:CO2>SiO2>Na2O>SO3 d.还原![]() 性:PH3>H2S>HCl>HF
性:PH3>H2S>HCl>HF
(5)下表为部分非金属元素与氢形成共价键的键长与键能数据:
| 共价键 | H-H | H-F | H-Cl | H-Br | H-O | H-S | H-N | H-P |
| 键长(pm) | 74 | 92 | 127 | 141 | 98 | 135 | 101 | 321 |
| 键能(kJ/mol) | 436 | 568 | 432 | 368 | 464 | 364 | 391 | 142 |
根据表中数据,归纳共价键键能与键长的关系_______________________________________。
(13分)组成生命细胞的11种常量元素(约占人体总质量的99.97%),全部位于周期表的前20号。其中组成人体蛋白质、脂肪、碳水化合物和核酸的主要有6种元素。
(1)这六种元素中除H、C、O、P、S外,应该还有____(写元素符号),它的基态原子核外电子排布式是 ,其第一电离能比O的________(填“大”或“小”);与它同周期,且单质熔点最高的元素在周期表中的位置 。
(2)CO2是一种温室气体,它的电子式为 ,将其转变其他化工原料,必须破坏的化学键属于 (填“极性”或“非极性”)键。
(3)元素周期表中元素的性质存在递变规律,下列关系正确的是____(填序号)。
a.离子半径:S2-> Na+>O2->H+ b.与水反应的剧烈程度:K>Na>Mg>Ca
c.熔点:CO2>SiO2>Na2O>SO3 d.还原性:PH3>H2S>HCl>HF
(4)下表为部分非金属元素与氢形成共价键的键长与键能数据:
根据表中数据,归纳共价键键能与键长的关系
。
组成生命细胞的11种宏量元素(约占人体总质量的99.97%),全部位于周期表的前20号。其中组成人体蛋白质、脂肪、碳水化合物和核酸的主要有6种元素。
(1)这六种元素中除H、C、O、P、S外,应该还有______(写元素符号),它的原子最外层共有______种不同运动状态的电子;与它同周期,且单质熔点最高的元素在周期表中的位置_______________________。
(2)糖类是人体获得能量的来源之一。已知1mol 葡萄糖在人体内完全氧化为二氧化碳和水,放出2804 kJ的热量,该反应的热化学方程式_______________________________________。
(3)CO2是一种温室气体,它的电子式为______________,将其转变其他化工原料,必须破坏的化学键属于_________(填“极性”或“非极性”)键。
(4)元素周期表中元素的性质存在递变规律,下列关系正确的是______(填序号)。
a.离子半径:S2—>Na+>O2—>H+ b.与水反应的剧烈程度:K>Na>Mg>Ca
c.熔点:CO2>SiO2>Na2O>SO3 d.还原性:PH3>H2S>HCl>HF
(5)下表为部分非金属元素与氢形成共价键的键长与键能数据:
| 共价键 | H-H | H-F | H-Cl | H-Br | H-O | H-S | H-N | H-P |
| 键长(pm) | 74 | 92 | 127 | 141 | 98 | 135 | 101 | 321 |
| 键能(kJ/mol) | 436 | 568 | 432 | 368 | 464 | 364 | 391 | 142 |
根据表中数据,归纳共价键键能与键长的关系_______________________________________。
(13分)组成生命细胞的11种常量元素(约占人体总质量的99.97%),全部位于周期表的前20号。其中组成人体蛋白质、脂肪、碳水化合物和核酸的主要有6种元素。
(1)这六种元素中除H、C、O、P、S外,应该还有____(写元素符号),它的基态原子核外电子排布式是 ,其第一电离能比O的________(填“大”或“小”);与它同周期,且单质熔点最高的元素在周期表中的位置 。
(2)CO2是一种温室气体,它的电子式为 ,将其转变其他化工原料,必须 破坏的化学键属于 (填“极性”或“非极性”)键。
破坏的化学键属于 (填“极性”或“非极性”)键。
(3)元素周期表中元素的性质存在递变规律,下列关系正确的是____(填序号)。
a.离子半径:S2-> Na+>O2->H+ b.与水反应的剧烈程度:K>Na>Mg>Ca
c.熔点:CO2>SiO2>Na2O>SO3 d.还原性:PH3>H2S>HCl>HF
(4)下表为部分非金属元素与氢形成共价键的键长与键能数据: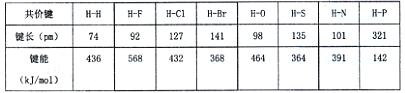
根据表中数据,归纳共价键键能与键长的关系
。
(13分)组成生命细胞的11种常量元素(约占人体总质量的99.97%),全部位于周期表的前20号。其中组成人体蛋白质、脂肪、碳水化合物和核酸的主要有6种元素。
(1)这六种元素中除H、C、O、P、S外,应该还有____(写元素符号),它的基态原子核外电子排布式是 ,其第一电离能比O的________(填“大”或“小”);与它同周期,且单质熔点最高的元素在周期表中的位置 。
(2)CO2是一种温室气体,它的电子式为 ,将其转变其他化工原料,必须破坏的化学键属于 (填“极性”或“非极性”)键。
(3)元素周期表中元素的性质存在递变规律,下列关系正确的是____(填序号)。
a.离子半径:S2-> Na+>O2->H+ b.与水反应的剧烈程度:K>Na>Mg>Ca
c.熔点:CO2>SiO2>Na2O>SO3 d.还原性:PH3>H2S>HCl>HF
(4)下表为部分非金属元素与氢形成共价键的键长与键能数据:
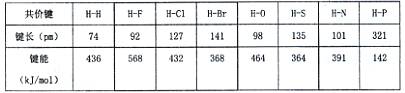
根据表中数据,归纳共价键键能与键长的关系
。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com