
题目列表(包括答案和解析)
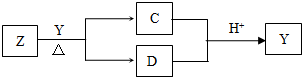 Y是短周期元素组成的单质,为淡黄色固体.Z是一种化合物,焰色反应呈黄色,0.1mol?L-1 Z的水溶液pH=13;C、Y、D都含同一种元素,且此元素化合价依次升高.C、D的水溶液均显碱性.
Y是短周期元素组成的单质,为淡黄色固体.Z是一种化合物,焰色反应呈黄色,0.1mol?L-1 Z的水溶液pH=13;C、Y、D都含同一种元素,且此元素化合价依次升高.C、D的水溶液均显碱性.l mol MnO2粉末加入50mL过氧化氢的溶液里(ρ=1.1g•L-1),在标准状况下,放出气体的体积y和时间t的关系曲线如图所示。
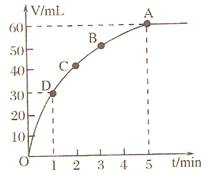
(1)实验时放出气体总体积是__________。
(2)放出一半气体所需的时间约为__________。
(3)A、B、C、D各点反应速率快慢的顺序是__________。
(4)过氧化氢溶液的初始物质的量浓度为__________。
|
L、X、Y、Z、W为四种短周期主族元素.其中X、Z同族,Y、Z同周期,W与X、Y既不同族也不同周期;X原子最外层电子数是核外电子层数的3倍;Y的最高正价与最低负价的代数和为6.下列说法正确的是 | |
A. |
Y元素最高价氧化物对应水化物的化学式为H2YO4 |
B. |
原子半径由小到大的顺序为:W<Y<Z |
C. |
X与W可以形成W2X、W2X2两种氧化物 |
D. |
Y、Z两元素的气态氢化物中,Z的气态氢化物最稳定 |
| X | Y | W | |
| n(起始状态)/mol | 2 | 1 | 0 |
| n(平衡状态)/mol | 1 | 0.5 | 1.5 |
| A、升高温度,若W的体积分数减小,则此反应△H>0 |
| B、该温度下,此反应的平衡常数K=6.75 |
| C、增大压强,正、逆反应速率均增大,平衡向正反应方向移动 |
| D、该温度下,再向该容器中加入1.5mol W,达到新平衡时,c(X)=0.75mol?L-1 |

A.氯化铝、氯化铁、氢氧化钠?
B.氯化铝、氯化镁、氢氧化钠??
C.偏铝酸钠、氢氧化钡、硫酸?
D.偏铝酸钠、氯化钡、硫酸?
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com