
题目列表(包括答案和解析)
(10分)A、B、C是三种中学化学常见的固体化合物,焰色反应均显黄色。已知实验事实如下:
①A与B按1:1的物质的量相混合,溶于足量的水,得到的溶液只含一种溶质。在该溶液中通入足量的CO2,则得到溶质为B的溶液。
②A与C按任意比混合,溶于足量的水,得到的溶液也只含一种溶质,并有无色、无气味的气体D放出。
③加热B与C的混合物,放出的气体中含有D。
据此回答下列问题:
5-1.A、B、C的化学式依次是:( )
5-2.写出A与B在溶液中反应的离子方程式:
5-3.写也实验①中溶液通过足量的CO2时所发生反应的离子方程式;
5-4.写出B与C按物质的量1:1在密闭容器内混合加热、相互完全反应时的化学方程式;
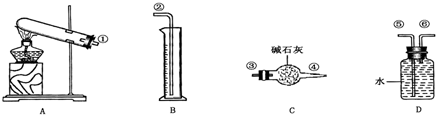
 (2012?宜春模拟)硫酸铜受热分解生成氧化铜和气体,受热温度不同,该气体成分也不同.气体成分可能含SO2、SO3和O2中的一种、二种或三种.某化学课外活动小组通过设计一探究性实验,测定反应产生的SO2、SO3和O2的物质的量,并经计算确定各物质的化学计量数,从而确定CuSO4分解的化学方程式.实验用到的仪器如图所示:
(2012?宜春模拟)硫酸铜受热分解生成氧化铜和气体,受热温度不同,该气体成分也不同.气体成分可能含SO2、SO3和O2中的一种、二种或三种.某化学课外活动小组通过设计一探究性实验,测定反应产生的SO2、SO3和O2的物质的量,并经计算确定各物质的化学计量数,从而确定CuSO4分解的化学方程式.实验用到的仪器如图所示:| 实验 小组 |
称取CuSO4 的质量/g |
仪器C增 加的质量/g |
量筒中水的体积折算标 准状况下气体的体积/mL |
| ① | 6.4 | 2.56 | 224 |
| ② | 6.4 | 2.56 | 448 |
| ||
| ||
| 10 |
| 9 |
| 实验 小组 |
称取CuSO4 的质量/g |
仪器C增 加的质量/g |
量筒中水的体积折算成标 准状况下气体的体积/mL |
| ① | 6.4 | 2.88 | 224 |
| ② | 6.4 | 2.56 | 448 |
| ||
| ||
| ||
| ||

| 实验小组 | 称取CuSO4 的质量(g) |
装置C增加 的质量(g) |
量筒中水的体积折算成标 准状况下气体的体积(mL) |
| 一 | 6.4 | 2.56 | 298.7 |
| 二 | 6.4 | 2.56 | 448 |
| ||
| ||
| ||
| ||
(17分)硫酸铜受热分解生成氧化铜和气体,受热温度不同,该气体成分也不同。气体成分可能含SO2、SO3和O2中的一种、二种或三种。某化学课外活动小组通过设计一探究性实验,探索测定反应产生的SO2、SO3和O2的物质的量,并经计算确定各物质的化学计量数,从而确定CuSO4分解的化学方程式。实验可能用到的仪器如下图所示:

【提出猜想】
Ⅰ.所得气体的成分可能只含 一种;
Ⅱ.所得气体的成分可能含有 二种;
Ⅲ.所得气体的成分可能含有 三种。
【实验探究】
实验操作过程(略)。已知实验结束时,硫酸铜完全分解。请回答下列问题:
(1) 请你组装探究实验的装置,按从左至右的方向,各仪器接口连接顺序为:
__ (填序号)
(2) 若实验结束,B中量筒没有收集到水,则证明猜想 正确。
(3)若实验结束,经测定装置C的总质量增加了,能否肯定气体产物中含有SO2而不含SO3?
请说明理由。答:
(4)有两个实验小组进行该实验,由于加热时的温度不同,实验结束后,测得相关数据也不同,数据如下:
|
实验小组 |
称取CuSO4 的质量(g) |
装置C增加 的质量(g) |
量筒中水的体积折算成标 准状况下气体的体积(mL) |
|
一 |
6.4 |
2.56 |
298.7 |
|
二 |
6.4 |
2.56 |
448 |
请通过计算,推断出第一小组和第二小组的实验条件下CuSO4分解的化学反应方程式:
一组:_____________ ;
二组:_ 。
(5)该实验设计中,由于实验操作的原因容易给测定带来最大误差的两个仪器是________和_______(填代号)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com