
题目列表(包括答案和解析)
某校研究性学习小组的同学进行了以下化学实验:将金属钙置于空气中燃烧,然后向所得固体产物中加入一定量蒸馏水,此过程中反应放出大量的热,并且放出有臭味的气体。
(1)甲同学提出:运用类比学习的思想,Ca与Mg是同一主族元素,化学性质具有一定的相似性。
请写出Ca在空气中燃烧发生反应的化学方程式: 。
(2)乙同学提出:Ca的性质比Na活泼,在空气中燃烧还应有CaO2生成,请写出燃烧后固体产物与水反应放出气体的化学方程式: 。
丙同学提出用实验的方法探究放出臭味气体的成份:
【查阅资料】1:CaO2遇水反应生成H2O2,H2O2可能会分解产生一定量的O3
2:碘量法是最常用的臭氧测定方法:其原理为强氧化剂臭氧(O3)与碘化钾(KI)水溶液反应生成游离碘(I2)。臭氧还原为氧气。反应式为:O3+2KI+H2O=O2+I2+2KOH 【提出假设】假设1:该臭味气体只有NH3;
假设2:该臭味气体只有 ;
假设3:该臭味气体含有 。
【设计方案进行实验探究】
(3)基于假设l,该小同学组设计如下实验方案,并进行实验。请在答题卡上按下表格式完成相关的实验操作步骤、预期现象及结论(仪器自选)。
【限选实验试剂】:红色石蕊试纸、蓝色石蕊试纸、pH试纸、淀粉一KI溶液、蒸馏水。设计实验方案证明你的假设,并按下表格式写出实验操作步骤、预期现象和结论。
|
实验操作 |
预期现象和结论 |
|
取少量反应后固体于试管中,
。 |
|
为探究铜与浓硫酸的反应,甲、乙两同学分别设计了图1、图2所示装置,将足量铜和10 mL 18 mol·L-1浓硫酸共热,直到无气体生成为止(假定反应前后试管中溶液的体积不变)。
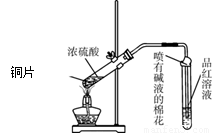

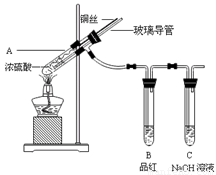 图1
图2
图1
图2
(1)比较两实验装置,图2装置的优点是:① ;② 。
(2)①甲根据所学的化学知识认为还有一定量的硫酸剩余。甲认为硫酸剩余的理论依据是 。
②下列药品中能够用来证明反应结束后的烧瓶中确有硫酸剩余的是_______。(选填编号)
A.过量铁粉 B.氯化钡溶液 C.银粉 D.碳酸氢钠溶液
(3)乙在拆除图2装置前,不打开胶塞,为使装置中的残留气体完全被吸收,应当采取的操作是 。
(4)为定量测定当剩余硫酸浓度不大于何值时,铜与硫酸就不能反应,甲、乙两位同学进行了如下设计:
①甲方案:将产生的气体缓缓通过预先称量过的盛有 的干燥管,反应结束后再次称量,干燥管质量增加m g。其余酸浓度为 mol·L-1。
②乙方案:分离出反应后的溶液并加蒸馏水稀释至1 000 mL,取20.00 mL于锥形瓶中,滴入2~3滴 ,(选填“酚酞”、“甲基橙”)用0.1000mol·L-1标准NaOH溶液进行滴定(已知氢氧化铜开始沉淀的pH约为5),用去NaOH溶液V mL。其余酸浓度为 mol·L-1。
③甲、乙两方案比较,你认为误差较大的是 ,理由是 。
为探究铜与浓硫酸的反应,甲、乙两同学分别设计了图1、图2所示装置,将足量铜和10 mL 18 mol·L-1浓硫酸共热,直到无气体生成为止(假定反应前后试管中溶液的体积不变)。 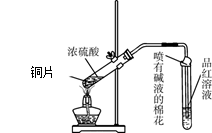

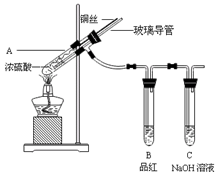 图1 图2
图1 图2
(1)比较两实验装置,图2装置的优点是:① ;② 。
(2)①甲根据所学的化学知识认为还有一定量的硫酸剩余。甲认为硫酸剩余的理论依据是 。
②下列药品中能够用来证明反应结束后的烧瓶中确有硫酸剩余的是_______。(选填编号)
| A.过量铁粉 | B.氯化钡溶液 | C.银粉 | D.碳酸氢钠溶液 |
利用铝热反应焊接钢轨的原理是2Al+Fe2O3![]() 2Fe+ Al2O3。某研究小组在实验室利用简易装置进行铝热反应。发现生成的铁呈疏松的褐色硬块。小组成员推测主要原因是产物铁含杂质较多,并进一步探究褪褐色硬块的组成。
2Fe+ Al2O3。某研究小组在实验室利用简易装置进行铝热反应。发现生成的铁呈疏松的褐色硬块。小组成员推测主要原因是产物铁含杂质较多,并进一步探究褪褐色硬块的组成。
样品处理:将褐色硬块处理成粉末状。
(1)研究小组首先取少量粉末加入 溶液中,发现粉末部分溶解,但没有气泡产生,实验结论是:粉末中含有Al2O3而没有Al。
(2)根据以述实验判断该褐色硬块的组成基本确定为Fe、Fe2O3、Al2O3。
提出假设:
假设1:固体粉末中除Al2O3外还有Fe;
假设2:固体粉末中除Al2O3外还有 ;
假设3:固体粉末中除Al2O3外还有Fe和Fe2O3。
实验实施:
(3)请以上述粉末为样品,验证其组成。限选实验仪器与试剂:烧杯、试管、玻璃棒、胶头滴管、药匙、过滤器;20%KSCN、3mol/LNaOH、3mol/LHCl、3mol/LHNO3、3mol/LCuSO4、0.01mol/LKMnO4、蒸馏水。
根据你设计的实验方案,叙述实验操作、预期现象和结论。
| 实验操作 | 预期现象和结论 |
|
| |
| 步骤2:将步骤1的滤渣转移到烧杯B中,加入足量 ,充分搅拌,过滤,洗涤。 | 有红色固体生成,说明粉末中含有
。 |
| 步骤3:将步骤2的滤渣转移到烧杯C中,
。 |
, 说明粉末中含有Fe2O3。 |
利用铝热反应焊接钢轨的原理是2Al+Fe2O3![]() 2Fe+ Al2O3。某研究小组在实验室利用简易装置进行铝热反应。发现生成的铁呈疏松的褐色硬块。小组成员推测主要原因是产物铁含杂质较多,并进一步探究褪褐色硬块的组成。
2Fe+ Al2O3。某研究小组在实验室利用简易装置进行铝热反应。发现生成的铁呈疏松的褐色硬块。小组成员推测主要原因是产物铁含杂质较多,并进一步探究褪褐色硬块的组成。
样品处理:将褐色硬块处理成粉末状。
(1)研究小组首先取少量粉末加入 溶液中,发现粉末部分溶解,但没有气泡产生,实验结论是:粉末中含有Al2O3而没有Al。
(2)根据以述实验判断该褐色硬块的组成基本确定为Fe、Fe2O3、Al2O3。
提出假设:
假设1:固体粉末中除Al2O3外还有Fe;
假设2:固体粉末中除Al2O3外还有 ;
假设3:固体粉末中除Al2O3外还有Fe和Fe2O3。
实验实施:
(3)请以上述粉末为样品,验证其组成。限选实验仪器与试剂:烧杯、试管、玻璃棒、胶头滴管、药匙、过滤器;20%KSCN、3mol/LNaOH、3mol/LHCl、3mol/LHNO3、3mol/LCuSO4、0.01mol/LKMnO4、蒸馏水。
根据你设计的实验方案,叙述实验操作、预期现象和结论。
| 实验操作 | 预期现象和结论 |
|
|
|
| 步骤2:将步骤1的滤渣转移到烧杯B中,加入足量 ,充分搅拌,过滤,洗涤。 | 有红色固体生成,说明粉末中含有
。 |
| 步骤3:将步骤2的滤渣转移到烧杯C中,
。 |
, 说明粉末中含有Fe2O3。(1分) |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com