
题目列表(包括答案和解析)
(6分)下列实验设计或操作合理的是 。
a.在催化剂存在的条件下,苯和溴水发生反应可生成无色比水重的液体溴苯;
b.只用水就能鉴别苯、硝基苯、乙醇;
c.实验室通过浓硫酸与乙醇反应制取乙烯时,必须将温度计的水银球插入反应液中,测定反应液的温度;
d.将10滴溴乙烷加入1mL10%的烧碱溶液中加热片刻后,再滴加2滴2%的硝酸银溶液,以检验水解生成的溴离子;
e.工业酒精制取无水酒精时先加生石灰然后蒸馏,蒸馏必须将温度计的水银球插入反应液中,测定反应液的温度;
f.将1-溴丙烷与浓硫酸反应用酸性KMnO4溶液直接检验是否得到乙烯。

(16分)Fe、Cu都是人类较早使用的金属,某校化学研究性学习小组的同学运用实验的手段研究Fe、Cu以及化合物的相关性质。请你参与研究并回答下列问题:
(1)甲同学完成了Fe、Cu分别与S、Cl2反应的实验,下列物质中不可能为甲同学实验得到的生成物是
A.FeCl3 B.FeCl2 C.CuCl2 D.FeS
(2)乙同学为验证Fe能和热的浓HNO3反应,设计了如上图所示的实验装置,请说出装置B的作用: 。开始加热前 (填“有”或“无”)明显现象。
(3)当乙同学实验结束时,铁完全溶解,试管液面上方为无色气体,试管上部为红棕色气体,此时丙同学用所得的溶液进行如下实验和探究:
①在所得的溶液中加入一小块Cu片,结果Cu片先逐渐溶解,并伴随其他现象,反应一段时间后不再溶解。丙同学依据反应现象得出Cu片溶解的原因可能是和过量的HNO3发生反应。他依据的反应现象是 ;该反应的离子方程式为 。你认为Cu片溶解是否还有另一原因,若有请用化学方程式表示其理由: (若无此空不填)
②请你设计实验证明在加入Cu片并反应完全后的溶液中含有Fe2+但不含有Fe3+。说明具体的操作和实验现象 。
③丙同学实验结束后加水稀释后得到溶液500mL,假设实验全过程硝酸只被还原成NO和
NO2共0.02 mol并测得溶液中Fe2+和Cu2+浓度均为0.02 mol/L,则NO3-的物质的量浓度为
mol/L。生成NO气体的体积为_________________L(标准状况)。
(4)本次探究实验用掉密度为1.5g·cm-3质量分数为95%的浓硝酸3mL,超出实际参加反应的量其原因有(写出两点):① ②
(16分)Fe、Cu都是人类较早使用的金属,某校化学研究性学习小组的同学运用实验的手段研究Fe、Cu以及化合物的相关性质。请你参与研究并回答下列问题:
(1)甲同学完成了Fe、Cu分别与S、Cl2反应的实验,下列物质中不可能为甲同学实验得到的生成物是
A.FeCl3B.FeCl2 C.CuCl2D.FeS
(2)乙同学为验证Fe能和热的浓HNO3反应,设计了如上图所示的实验装置,请说出装置B的作用: 。开始加热前 (填“有”或“无”)明显现象。
(3)当乙同学实验结束时,铁完全溶解,试管液面上方为无色气体,试管上部为红棕色气体,此时丙同学用所得的溶液进行如下实验和探究:
①在所得的溶液中加入一小块Cu片,结果Cu片先逐渐溶解,并伴随其他现象,反应一段时间后不再溶解。丙同学依据反应现象得出Cu片溶解的原因可能是和过量的HNO3发生反应。他依据的反应现象是 ;该反应的离子方程式为 。你认为Cu片溶解是否还有另一原因,若有请用化学方程式表示其理由: (若无此空不填)
②请你设计实验证明在加入Cu片并反应完全后的溶液中含有Fe2+但不含有Fe3+。说明具体的操作和实验现象 。
③丙同学实验结束后加水稀释后得到溶液500mL,假设实验全过程硝酸只被还原成NO和
NO2共0.02 mol并测得溶液中Fe2+和Cu2+浓度均为0.02 mol/L,则NO3-的物质的量浓度为
mol/L。生成NO气体的体积为 _________________L(标准状况)。
(4)本次探究实验用掉密度为1.5g·cm-3质量分数为95%的浓硝酸3mL,超出实际参加反应的量其原因有(写出两点):① ②
(16分)Fe、Cu都是人类较早使用的金属,某校化学研究性学习小组的同学运用实验的手段研究Fe、Cu以及化合物的相关性质。请你参与研究并回答下列问题: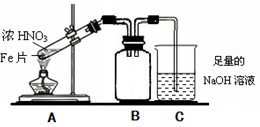
(1)甲同学完成了Fe、Cu分别与S、Cl2反应的实验,下列物质中不可能为甲同学实验得到的生成物是
| A.FeCl3 | B.FeCl2 | C.CuCl2 | D.FeS |
一、选择题(本题包括6小题,每小题4分,共24分。每小题只有一个选项符合题意)
1.B 2.C 3.B 4.A 5.D 6.A
二、选择题(本题包括9小题,每小题4分,共36分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该小题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给满分,但只要选错一个该小题就为0分。)
7.AD 8.D 9.B 10.AC 11.BD 12.C 13.D 14.A 15.BC
三.(本题包括2小题,共22分)
16.⑴cd ⑵①硫酸溶液、氢氧化钾溶液 ②1┱4
(除第⑴小题4分外,其余每空2分,共8分)
17.⑴①溶液蓝色恰好褪去所需的时间,吸收前后颗粒吸附剂、棉花、盛放容器的总质量
②同时加入少量碘化钾固体,用适量水使之完全溶解 将第一步所得溶液全部转入1000mL的容量瓶中,定容,摇匀
⑵①800 ②抽气速度过快,或装置气密性较差
③将50mL5×10-4mol/L的碘溶液的体积减小为5mL,并将广口瓶改为试管
⑶④ (每空2分,共14分)
四.(本题包括3小题,共30分)
18.⑴第三周期、ⅠA族 ⑵①C+4HNO3(浓)CO2↑+4NO2↑+2H2O
②2Na2O2+2CO2=2Na2CO3+O2 ⑶ (每空2分,共8分)
19.⑴①该晶体是分子晶体,各分子间存在较弱的分子间作用力,故“可燃冰”熔沸点较低
②890.3 kJ?mol-1
⑵①O2+4e=2 O2? 向负极移动 ②固体碳(或炭粒)
⑶寻找新能源,提高燃料的燃烧效率等
(每空2分,共12分)
20.⑴H2O2 ⑵acdefgj 合成塔 ⑥ ⑶Fe4S5+8O22Fe2O3+5SO2
(除第⑵小题第2、3空1分外,其余每空2分,共10分)
五.(本题包括2小题,共20分)
21.⑴乙基 C9H12O3 ⑵与NaOH溶液在加热条件下反应
⑶ (每空2分,共8分)
22.⑴加成反应 ⑵⑥ 保护B(或G)分子中的C=C不被氧化
⑶
⑷ HOOCCH2CHClCOOH+3NaOHNaOOCCH=CHCOONa+NaCl+3H2O
2CH3CH2CH2CH2OH+HOOCCH=CHCOOH
CH3(CH2)3OOCCH=CHCOO(CH2)3CH3+2H2O (每空2分,共12分)
六.(本题包括2小题,共18分)
23.⑴CaCO3?MgCO3 (4分)
⑵由于炭粉过量,则白云石分解后的产物与炭粉反应完全,据氧元素守恒知,CaCO3?MgCO3→6CO,则V ==0.73am (4分)
24.⑴设乙烯总量为1mol,第①步反应消耗乙烯为xmol,则第②步产生的CH3COOH为x?75%×80%=0.6x。
由反应③知:=
即:x= 1-x=
故两次投料比为=x:(1-x)=5:3。 (4分)
⑵n(CH2=CH2)==1×106mol
m(CH3COOCH=CH2)=1×106mol××75%×86g/mol=2.42×107g=2.42×104kg(3分)
⑶ 第①步消耗氧气:n(O2)1=n(CH2=CH2)××=n(CH2=CH2)
第②步消耗氧气:n(O2)2=n(CH2=CH2)××75%×=n(CH2=CH2)
第③消耗氧气:n(O2)3=n(CH2=CH2)×=n(CH2=CH2)
n(O2)总=n(CH2=CH2)+n(CH2=CH2)+n(CH2=CH2)=n(CH2=CH2)
n(空气)=5×n(CH2=CH2)=n(CH2=CH2)
故:= (3分)
注:答题中出现的其它合理答案均给分
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com