
题目列表(包括答案和解析)
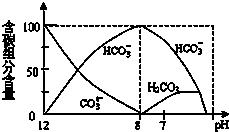 在含有弱电解质的溶液中,往往有多个化学平衡共存.
在含有弱电解质的溶液中,往往有多个化学平衡共存.| 温度 | v(H2C2O4) | v(KMnO4) | KMnO4褪色时间 |
| 40℃ | 10ml | 10ml | 40s |
| 40℃ | 20ml | 20ml |
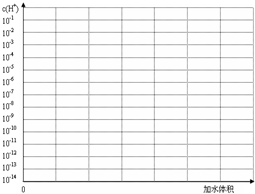
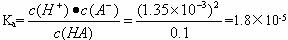
(1)恰好完全中和时(B点)溶液的pH_______7(填“>”“<”或“=”),理由是______________。
(2)当弱电解质AB在水溶液里达到平衡时:AB![]() A++B-,即有K电离=
A++B-,即有K电离=![]()
式中c(A+)·c(B-)、c(AB)分别表示粒子A+、B-、AB电离平衡时的物质的量浓度,K电离是弱电解质的电离平衡常数,简称电离常数,一定温度下,电离常数不随溶液浓度改变而改变,通过上述材料的阅读,求本题中一元弱酸的电离常数。
(3)求A点的pH。(lg1.35=0.13 lg1.8=0.26)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com