
题目列表(包括答案和解析)
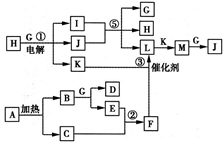 “酒后醉驾”成为社会热点问题之一,有一种离子化合物A,可用于小汽车防撞保护气囊,加强对驾驶员的保护,其由两种元素组成,摩尔质量为65g/mol,加热时可以生成两种单质.
“酒后醉驾”成为社会热点问题之一,有一种离子化合物A,可用于小汽车防撞保护气囊,加强对驾驶员的保护,其由两种元素组成,摩尔质量为65g/mol,加热时可以生成两种单质.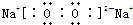
| ||
| ||
考生注意:23题为分叉题,分A、B两题,考生可任选一题。若两题均做,一律按A题计分。A题适合使用二期课改新教材的考生解答,B题适合使用一期课改教材的考生解答。
(A)现有部分短周期元素的性质或原子结构如下表:
| 元素编号 | 元素性质或原子结构 |
| T | M层上有2对成对电子 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 元素最高正价是+7价 |
(1)元素T的原子最外层共有 种不同运动状态的电子。元素X的一种同位素可测定文物年代,这种同位素的符号是
(2)元素Y与氢元素形成一种离子YH4+,写出该微粒的电子式 (用元素符号表示)
(3)元素Z与元素T相比,非金属性较强的是 (用元素符号表示),下列表述中能证明这一事实的是
a.常温下Z的单质和T的单质状态不同 b.Z的氢化物比T的氢化物稳定
c.一定条件下Z和T的单质都能与氢氧化钠溶液反应
(4)探寻物质的性质差异性是学习的重要方法之一。T、X、Y、Z四种元素的最高价氧化物的水化物中化学性质明显不同于其他三种酸的是 ,理由是
。
(B)现有部分短周期元素的性质或原子结构如下表:
| 元素编号 | 元素性质或原子结构 |
| T | 单质能与水剧烈反应,所得溶液呈弱酸性 |
| X | L层p电子数比s电子数多2个 |
| Y | 第三周期元素的简单离子中半径最小 |
| Z | L层有三个未成对电子 |
考生注意:23题为分叉题,分A、B两题,考生可任选一题。若两题均做,一律按A题计分。A题适合使用二期课改新教材的考生解答,B题适合使用一期课改教材的考生解答。
(A)现有部分短周期元素的性质或原子结构如下表:
| 元素编号 | 元素性质或原子结构 |
| T | M层上有2对成对电子 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 元素最高正价是+7价 |
(1)元素T的原子最外层共有 种不同运动状态的电子。元素X的一种同位素可测定文物年代,这种同位素的符号是
(2)元素Y与氢元素形成一种离子YH4+,写出该微粒的电子式 (用元素符号表示)
(3)元素Z与元素T相比,非金属性较强的是 (用元素符号表示),下列表述中能证明这一事实的是
a.常温下Z的单质和T的单质状态不同 b.Z的氢化物比T的氢化物稳定
c.一定条件下Z和T的单质都能与氢氧化钠溶液反应
(4)探寻物质的性质差异性是学习的重要方法之一。T、X、Y、Z四种元素的最高价氧化物的水化物中化学性质明显不同于其他三种酸的是 ,理由是
。
(B)现有部分短周期元素的性质或原子结构如下表:
| 元素编号 | 元素性质或原子结构 |
| T | 单质能与水剧烈反应,所得溶液呈弱酸性 |
| X | L层p电子数比s电子数多2个 |
| Y | 第三周期元素的简单离子中半径最小 |
| Z | L层有三个未成对电子 |
A.滴定用的锥形瓶和滴定管都要用所盛溶液润洗
B.制备(收集)任何气体开始实验前,都要首先检查装置的气密性
C.在中学《硫酸铜晶体里结晶水含量测定》的实验中,称量操作至少需要四次
D.测定溶液的pH时,应先将pH试纸润湿
E.配制硫酸溶液时,可先在量筒内加入一定体积的水,再在搅拌下慢慢加入浓硫酸
F.燃着的酒精灯不慎碰翻失火,应立即用湿布盖灭
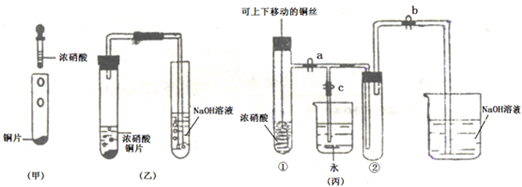
(Ⅱ)下图甲是旧教材中验证铜与浓硝酸反应的装置,乙是新教材对演示实验改进后的装置,丙是某校师生对乙作进一步改进并对所产生的气体的性质进行探究的装置。
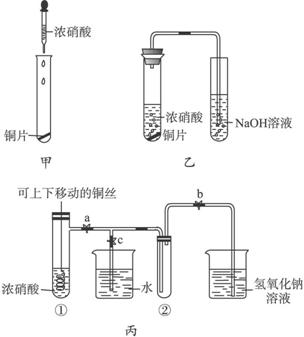
(1)与甲装置相比,乙装置的优点是______________,丙装置除具有乙装置优点外还具有的优点是______________。(写出一点即可)
(2)欲使NO2气体充满试管②,应先关闭弹簧夹______________,再打开弹簧夹______________,当气体充满②后,将铜丝提起与溶液脱离,然后把a、b、c都关闭,并把试管②置于沸水中,下列情况不变的是______________。
A.颜色 B.平均摩尔质量 C.压强 D.密度
(3)为了验证NO2与水的反应,欲使烧杯中的水进入试管②的操作是______________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com