
题目列表(包括答案和解析)
(16分)某校化学兴趣小组为了测定铁碳合金中铁的质量分数,并探究浓硫酸的某些性质,设计了下图所示的实验装置和实验方案(夹持仪器已省略),请你参与此项活动并回答相应问题。
I、探究浓硫酸的某些性质
(1)按图示的连接装置,检查装置的气密性,称量E的质量。
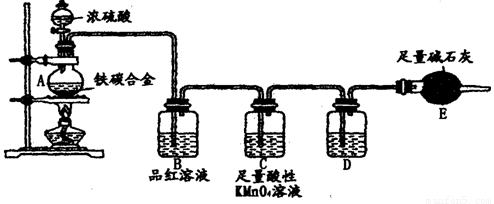
(2)将m g铁碳合金样品放入A中,再加入适量的浓硫酸。未点燃酒精灯前,A、B容器中均无明显现象,其原因是:___________________________________。
(3)点燃酒精灯一段时间后,A、B中可观察到明显的现象。
写出A中发生反应的化学方程式________________、____________________。
(4)反应一段时间后,从A中逸出气体的速率仍然较快,除因温度较高,反应放热外,还可能的原因是_________________________________________________。
Ⅱ、测定铁的质量分数
(5)待A中不再逸出气体时,停止加热,拆下E并称重。E增重b g。则铁碳合金中铁的质量分数为_________________________(用含m、b的表达式表示)。
(6)甲同学认为,依据此实验测得的数据,计算合金中铁的质量分数可能会偏低,原因是空气中CO2、H2O进入E管使b增大。你认为改进的方法是_________________。
(7)乙同学认为,即使甲同学认为的偏差得到改进,依据此实
验测得合金中铁的质量分数也可能会偏高。你认为其中的原因
是__________________。
(8)某同学认为上述方法较复杂,使用下图所示的装置和其他
常用实验仪器测定某些数据即可。为了快速准确的计算出铁的
质量分数,最简便的实验操作是_____________(填写代号)。

A.用排水法测定H2的体积
B.反应结束后,过滤、洗涤、干燥、称量残渣的质量
C.测定反应前后装置和药品的总质量

| ||
| ||

| ||
| ||
 固定和利用CO2能有效地利用资源,并减少空气中的温室气体.工业上有一种用CO2来生产甲醇燃料的方法:
固定和利用CO2能有效地利用资源,并减少空气中的温室气体.工业上有一种用CO2来生产甲醇燃料的方法: CH3OH(g)+H2O(g)+49kJ
CH3OH(g)+H2O(g)+49kJ
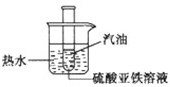 Na与FeS04溶液反应,一般很难完整地观察到反应全过程的有关现象.有人用如图所示装置进行实验改进:先将试管内新制备的FeS04溶液液面上覆盖一薄层汽油,然后将试管放入烧杯中,待试管内汽油层消失后,往试管内投入一小粒钠,并迅速塞上带导管的单孔塞.
Na与FeS04溶液反应,一般很难完整地观察到反应全过程的有关现象.有人用如图所示装置进行实验改进:先将试管内新制备的FeS04溶液液面上覆盖一薄层汽油,然后将试管放入烧杯中,待试管内汽油层消失后,往试管内投入一小粒钠,并迅速塞上带导管的单孔塞.湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com