
题目列表(包括答案和解析)
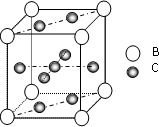 A、B、C、D、E、F 是第四周期的元素其单质均为固体,其相关的性质如下:
A、B、C、D、E、F 是第四周期的元素其单质均为固体,其相关的性质如下:


| ||
| △ |
| ||
| △ |
| 催化剂 |
| △ |
| 催化剂 |
| △ |

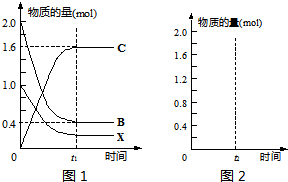
(8分)A、B、C、X均为中学常见的纯净物,它们之间有如下转化关系(副产物已略去)。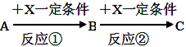
试回答:
(1)若X是强氧化性单质,则A不可能是________。
a.S b.N2 c.Na d.Mg e.Al
(2)若X是金属单质,向C的水溶液中滴加AgNO3溶液,产生不溶于稀硝酸的白色沉淀,则B的化学式为____ ____;C溶液在储存时应加入少量X,目的是______________________ 。
(3)若A是厨房常用的一种调味剂,则反应①的化学方程式为: ;
A与C反应可以生成一种有芳香气味的物质,该物质的结构简式为: 。
(8分)A、B、C、X均为中学常见的纯净物,它们之间有如下转化关系(副产物已略去)。
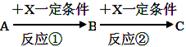
试回答:
(1)若X是强氧化性单质,则A不可能是________。
a.S b.N2 c.Na d.Mg e.Al
(2)若X是金属单质,向C的水溶液中滴加AgNO3溶液,产生不溶于稀硝酸的白色沉淀,则B的化学式为____ ____;C溶液在储存时应加入少量X,目的是______________________ 。
(3)若A是厨房常用的一种调味剂,则反应①的化学方程式为: ;
A与C反应可以生成一种有芳香气味的物质,该物质的结构简式为: 。
A、B、C、D、E五种短周期元素,原子序数依次增大,其中只有C为金属元素。A、C原子序数之和等于E的原子序数,D与B同主族且D原子序数是B原子序数的2倍。AB2和DB2溶于水得到酸性溶液,C2D溶于水得到碱性溶液。
(1)E元素在周期表中的位置为 ;工业上制取C单质的化学方程式为 。
(2)A的最低负价氢化物的空间构型为 ;C、D、E的简单离子的离子半径由大到小的顺序是 (用离子符号表示)。
(3)在低温下,将E的单质通人饱和NaHCO3溶液中,反应后得到一种微绿色气体易E2B、CE和另外一种无色气体。则该反应中E2B、CE这两种产物的物质的量之比
n(E2B):n(CE)= 。已知E2B溶于水生成一种具有漂白性的弱酸,该弱酸分子的结构式为 。
(4)化合物C2 D3中,各原子(或离子)最外层均达到8电子稳定结构,则C2D3的电子式为 ,该化合物的水溶液在空气中久置后变质,生成一种单质,所得溶液呈强碱性,用化学方程式表示这一变化过程 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com