
题目列表(包括答案和解析)
 (1)原电池反应通常是放热反应,下列化学反应在理论上可设计成原电池是
(1)原电池反应通常是放热反应,下列化学反应在理论上可设计成原电池是
(1)原电池反应通常是放热反应,下列化学反应在理论上可设计成原电池是 ,理由是 。
A.C(s)+H2O(g)=CO(g)+H2(g) △H>O
B.C(s)+ CO2(g)= 2CO(g) △H>O
C.CaC2(s)+2H2O (g)=Ca(OH)2(l)+C2H2(g)△H<O
D.CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H<O
(2)以KOH溶液为电解质溶液,依据(1)所选反应设计一个原电池,其负极反应式为 ;以H2SO4溶液为电解质溶液,将(1)中D选项的CH4改为C6H12O6,其负极反应式为
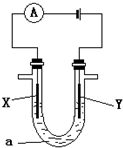
(3)电解原理在化工上有着广泛的应用,现将你设计的原电池通过导线与下图中的电解池相连,其中a为电解质溶液,X和Y为两块电极板,则:

①若X和Y均为惰性电极,a为饱和的NaCl溶液,则检验Y电极产物的方法是
②若X和Y分别为石墨和铁,a仍为饱和的NaCl溶液,则阳极反应式为
③若X和Y均为惰性电极,a为CuSO4溶液,电解一段时间后,向所得溶液中加入0.1mol的Cu(OH)2,恰好使溶液恢复电解前的浓度和PH,则电解过程中阳极产生的气体体积(标况下)为
| 熔点/K | 沸点/K | 标准状况时在水中的溶解度 | |
| 甲 | 187 | 202 | 2.6 |
| 乙 | 272 | 423 | 以任意比互溶 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com