
题目列表(包括答案和解析)
(每空1分,共12分)
(1)浓硫酸与木炭粉在加热条件下的化学方程式为____________。
(2)已知酸性KMnO4溶液可以吸收SO2,试用图4-6所示各装置设计一个实验,验证上述反应所产生的各种产物。这些装置的连接顺序(按产物气流从左到右的方向)是(填装置的编号): __________→__________→__________→__________。
(3)实验时可观察到装置①中A瓶的溶液褪色,C瓶的溶液不褪色。A瓶溶液的作用是________,B瓶溶液的作用是_________,C瓶溶液的作用是_________________________。
(4)装置②中所加的固体药品是_______________,可确证的产物是_______。
(5)装置③中所盛溶液是__________,可验证的产物是__________。
(12分)
(1)乙烯通入溴的四氯化碳溶液中,观察到的现象是 ;其反应方程式为 ;乙烯在一定条件下发生加聚反应的化学方程式为 。
(2)苯分子的结构简式为 。苯能发生取代反应,请任写一个苯发生取代反应的化学方程式
(3)把卷成螺旋状的铜丝在酒精灯外焰上加热,使表面变黑,然后迅速伸到无水酒精中,有什么现象 ,写出总反应的化学方程式 ,铜丝在反应中起 的作用。
(12分)(1)“嫦娥一号”登月成功,实现了中国人“奔月”的梦想.“嫦娥一号”使用的推进剂是液氢和液氧,这种推进剂的优点是相同质量时,氢气放出的热量多,产物为水无污染。
已知:H2(g)+O2(g)=H2O(l) ΔH=-285.8 kJ/mol ; H2(g)=H2(l) ΔH=-0.92 kJ/mol
O2(g)=O2(l) ΔH=-6.84 kJ/mol ; H2O(l)=H2O(g) ΔH=+44.0 kJ/mol
请写出液氢和液氧生成气态水的热化学方程式:_______________________________.
(2)已知:①NH3(g)+HCl(g)===NH4Cl(s) ΔH=-176 kJ/mol
②NH3(g)+H2O(l)===NH3·H2O(aq) ΔH=-35.1 kJ/mol
③HCl(g)===HCl(aq) ΔH= -72.3 kJ/mol
④NH3·H2O(aq)+HCl(aq)===NH4Cl(aq)+H2O(l) ΔH=-52.3 kJ/mol
则NH4Cl(s)===NH4Cl(aq)的ΔH=______
(3)分别取40 mL的0.50 mol/L盐酸与0.55 mol/L氢氧化钠溶液进行中和反应.通过测定反应过程中所放出的热量可计算中和热.请回答下列问题.
① 理论上稀强酸、稀强碱反应生成1 mol水时放出57.3 kJ的热量,写出表示稀硫酸和稀氢氧化钠溶液反应的中和热的热化学方程式 __
② 假设盐酸和氢氧化钠溶液的密度都是1 g/cm3,又知中和后生成溶液的比热容
c=4.18 J/(g·℃).为了计算中和热,实验时还需测量的数据有(填序号)__________;
| A.反应前盐酸溶液的温度 | B.反应前盐酸溶液的质量 |
| C.反应前氢氧化钠溶液的温度 | D.反应前氢氧化钠溶液的质量 |
| 实验 序号 | 起始温度t1/℃ | 终止温度t2/℃ | |
| 盐酸 | 氢氧化钠 | 混合溶液 | |
| 1 | 20.0 | 20.1 | 23.2 |
| 2 | 20.2 | 20.4 | 23.4 |
| 3 | 20.5 | 20.6 | 23.6 |
(每空1分,共12分)
(1)浓硫酸与木炭粉在加热条件下的化学方程式为____________。
(2)已知酸性KMnO4溶液可以吸收SO2,试用图4-6所示各装置设计一个实验,验证上述反应所产生的各种产物。这些装置的连接顺序(按产物气流从左到右的方向)是(填装置的编号): __________→__________→__________→__________。
(3)实验时可观察到装置①中A瓶的溶液褪色,C瓶的溶液不褪色。A瓶溶液的作用是________,B瓶溶液的作用是_________,C瓶溶液的作用是_________________________。
(4)装置②中所加的固体药品是_______________,可确证的产物是_______。
(5)装置③中所盛溶液是__________,可验证的产物是__________。
(12分)(1)有A、B、C、D四种烃,在常温下A、C是气体,B、D是液体。A完全燃烧后生成二氧化碳与水物质的量之比是2:1;B的分子量是A的三倍;C既不能使酸性高锰酸钾溶液褪色也不能使溴水褪色,但在光照条件下最多可与六倍体积氯气发生反应;燃烧相同物质的量C与D,生成二氧化碳的体积比为1:4,D不能使溴水褪色但能使酸性高锰酸钾溶液褪色,在催化剂作用下1摩尔D能与3摩尔氢气完全反应;在铁粉存在下与溴反应生成一溴代物只有一种。试推断有机物A、B、C、D,分别写出结构简式:
A:______________ B:_____________
C:______________ D:___________
(2)相对分子质量为72的某烃,其分子式是___________,若此有机物的一氯代物分子中有两个-CH3、两个-CH2-、一个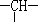 和一个-Cl,它可能的结构有__________种.(本题不考虑对映异构体)
和一个-Cl,它可能的结构有__________种.(本题不考虑对映异构体)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com