
题目列表(包括答案和解析)
常温下,在20.0mL 0.20mol/LCH3COONa溶液中滴加0.20mol/L的稀盐酸。溶液的Ph值的变化关系如右图所示。
(1) a >7.0的理由是(用离子方程式表示)
(2)如图,当加入稀盐酸的体积为V1mL时,溶液的pH值刚好为7.0。此时溶液中c(Cl-) c(CH3COOH)(填<、>或=)。简要写出判断依据
(3)当加入的盐酸的体积为20.0mL时,测定溶液中的c(H+)为1.3×10-3 mol/L,求CH3COH的电离平衡常数Ka(计算结果保留两位有效数字)。
常温下,在20.0mL 0.20mol/LCH3COONa溶液中滴加0.20mol/L的稀盐酸。溶液的Ph值的变化关系如右图所示。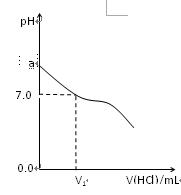
(1) a >7.0的理由是(用离子方程式表示)
(2)如图,当加入稀盐酸的体积为V1mL时,溶液的pH值刚好为7.0。此时溶液中c(Cl-) c(CH3COOH)(填<、>或=)。简要写出判断依据
(3)当加入的盐酸的体积为20.0mL时,测定溶液中的c(H+)为1.3×10-3 mol/L,求CH3COH的电离平衡常数Ka(计算结果保留两位有效数字)。
常温下,在20.0mL 0.20mol/LCH3COONa溶液中滴加0.20mol/L的稀盐酸。溶液的Ph值的变化关系如右图所示。
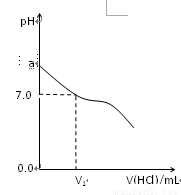
(1) a >7.0的理由是(用离子方程式表示)
(2)如图,当加入稀盐酸的体积为V1mL时,溶液的pH值刚好为7.0。此时溶液中c(Cl-) c(CH3COOH)(填<、>或=)。简要写出判断依据
(3)当加入的盐酸的体积为20.0mL时,测定溶液中的c(H+)为1.3×10-3 mol/L,求CH3COH的电离平衡常数Ka(计算结果保留两位有效数字)。
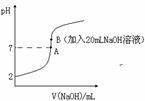
氢氟酸(HF)是一元弱酸,在水溶液中的电离方程式为:HF![]() H++F-。25℃下,向20mL0.2mol•L-1的氢氟酸中滴加0.2mol•L-1的NaOH溶液时,溶液的pH变化如图所示。
H++F-。25℃下,向20mL0.2mol•L-1的氢氟酸中滴加0.2mol•L-1的NaOH溶液时,溶液的pH变化如图所示。
 已知:电离度(
已知:电离度(![]() )和电离平衡常数(K)一样,可以用来衡量弱电解质在稀溶液中的电离能力。
)和电离平衡常数(K)一样,可以用来衡量弱电解质在稀溶液中的电离能力。![]()
请回答下列问题:
(1)在氢氟酸的稀溶液中,通过改变以下条件能使氢氟酸的电离度[![]() (HF)]增大的是_______,可使氢氟酸的电离平衡常数[Ka(HF)] 增大的是__________。
(HF)]增大的是_______,可使氢氟酸的电离平衡常数[Ka(HF)] 增大的是__________。
a.升高温度 b.向溶液中滴入2滴浓盐酸 c.加入少量NaF固体 d.加水稀释
(2)在此温度下,氢氟酸的电离平衡常数Ka(HF)为:__ ,
电离度![]() 为_ _%。
为_ _%。
(3)下列有关图中各点微粒浓度关系正确的是_______________。
a.在A处溶液中:c(F—)+c(HF)=0.2 mol•L-1
b.在B处溶液中:c(H+)+c(HF)= c(OH—)
c.在B处溶液中:c(Na+)>c(F—)>c(H+)>c(OH—)
d.在A和B处溶液中都符合:![]() = Ka(HF)
= Ka(HF)
(4)已知该温度下Ksp(CaF2)=1.5×10-10。取B点时的溶液10mL与90mL1×10-4 mol·L-1 CaCl2溶液混合,通过列式计算说明是否有沉淀产生。

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com