
题目列表(包括答案和解析)
已知2A(g)+B(g)  2C(g),△H=-a kJ/mol(a>0),在一个有催化剂的固定容积的容器中加入2molA和1molB,在500℃时充分反应达平衡后C的浓度为ωmol/L,放出热量为b kJ。
2C(g),△H=-a kJ/mol(a>0),在一个有催化剂的固定容积的容器中加入2molA和1molB,在500℃时充分反应达平衡后C的浓度为ωmol/L,放出热量为b kJ。
⑴比较a b(填“>”“=”或“<”)。
⑵下表为不同温度下该反应的平衡常数。由此可推知,表中T1 T2(填“>” “=”或“<”)。
|
T/K |
T1 |
T2 |
T3 |
|
K |
1.00×107 |
2.45×105 |
1.88×103 |
若在原来的容器中,只加入2molC,500℃时充分反应达平衡后,吸收热量为c kJ,C 的浓度 (填“>”、“=”或“<”)ωmol/L,a、b、c之间满足何种关系 (用代数式表示)。
⑶在相同条件下要想得到2a kJ热量,加入各物质的物质的量可能是 。
A.4molA和2molB B.4molA、2molB和2molC
C.4molA和4molB D.6molA和4molB
⑷为使该反应的反应速率增大,且平衡向正反应方向移动的是 。
A.及时分离出C气体 B.适当升高温度
C.增大B的浓度 D.选择高效催化剂
⑸若将上述容器改为恒压容器(反应前体积相同),起始时加入2molA和1molB,500℃时充分反应达平衡后,放出热量为d kJ,则d b(填“>”“=”或“<”),理由是 。
⑹在一定温度下,向一个容积可变的容器中,通入3molA和2molB及固体催化剂,使之反应,平衡时容器内气体压强为起始时的90%。保持同一反应温度,在相同容器中,将起始物质的量改为4molA、3molB和2molC,则平衡时A的百分含量 (填“不变”“变大”“变小”或“无法确定”)。
⑺某温度时,卤化银(AgX,X=Cl,Br,I)的3条溶解平衡曲线如图所示,AgCl,AgBr,AgI的Ksp依次减小。已知pAg=-lgc(Ag+),pX=-lgc(X-),利用pX-pAg的坐标系可表示出 AgX的溶度积与溶液中的c(Ag+)和c(X-)的相互关系。下列说法错误的是
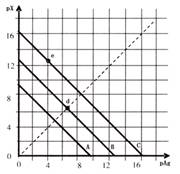
A.A线是AgCl,C线是AgI
B.e点表示由过量的KI与AgNO3反应产生AgI沉淀
C.d点是在水中加入足量的AgBr形成的饱和溶液
D.B线一定是AgBr
已知2A(g)+B(g) ![]() 2C(g),△H=-a kJ/mol(a>0),在一个有催化剂的固定容积的容器中加入2molA和1molB,在500℃时充分反应达平衡后C的浓度为ωmol/L,放出热量为b kJ。
2C(g),△H=-a kJ/mol(a>0),在一个有催化剂的固定容积的容器中加入2molA和1molB,在500℃时充分反应达平衡后C的浓度为ωmol/L,放出热量为b kJ。
⑴比较a b(填“>”“=”或“<”)。
⑵下表为不同温度下该反应的平衡常数。由此可推知,表中T1 T2(填“>” “=”或“<”)。
| T/K | T1 | T2 | T3 |
| K | 1.00×107 | 2.45×105 | 1.88×103 |
若在原来的容器中,只加入2molC,500℃时充分反应达平衡后,吸收热量为c kJ,C 的浓度 (填“>”、“=”或“<”)ωmol/L,a、b、c之间满足何种关系 (用代数式表示)。
⑶在相同条件下要想得到2a kJ热量,加入各物质的物质的量可能是 。
A.4molA和2molB B.4molA、2molB和2molC
C.4molA和4molB D.6molA和4molB
⑷为使该反应的反应速率增大,且平衡向正反应方向移动的是 。
A.及时分离出C气体 B.适当升高温度
C.增大B的浓度 D.选择高效催化剂
⑸若将上述容器改为恒压容器(反应前体积相同),起始时加入2molA和1molB,500℃时充分反应达平衡后,放出热量为d kJ,则d b(填“>”“=”或“<”),理由是 。
⑹在一定温度下,向一个容积可变的容器中,通入3molA和2molB及固体催化剂,使之反应,平衡时容器内气体压强为起始时的90%。保持同一反应温度,在相同容器中,将起始物质的量改为4molA、3molB和2molC,则平衡时A的百分含量 (填“不变”“变大”“变小”或“无法确定”)。
⑺某温度时,卤化银(AgX,X=Cl,Br,I)的3条溶解平衡曲线如图所示,AgCl,AgBr,AgI的Ksp依次减小。已知pAg=-lgc(Ag+),pX=-lgc(X-),利用pX-pAg的坐标系可表示出 AgX的溶度积与溶液中的c(Ag+)和c(X-)的相互关系。下列说法错误的是
A.A线是AgCl,C线是AgI
B.e点表示由过量的KI与AgNO3反应产生AgI沉淀
C.d点是在水中加入足量的AgBr形成的饱和溶液
D.B线一定是AgBr
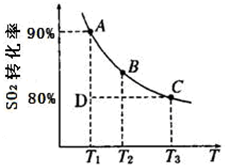 硫及其化合物在国民生产中占有重要的地位.
硫及其化合物在国民生产中占有重要的地位.| 1 | 2 |
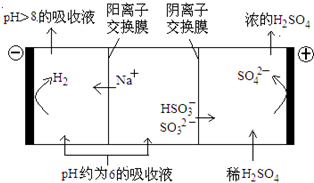 直接排放含SO2的烟气会形成酸雨,危害环境.利用钠碱循环法可脱除烟气中的SO2.
直接排放含SO2的烟气会形成酸雨,危害环境.利用钠碱循环法可脱除烟气中的SO2.| n(SO32-):n(HSO3-) | 91:9 | 1:1 | 1:91 |
| pH | 8.2 | 7.2 | 6.2 |
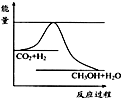 法是用CO2生产燃料甲醇.一定条件下发生反应:CO2(g)+3H2(g)
法是用CO2生产燃料甲醇.一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g),如右上图表示该反应进行过程中能量(单位为kJ?mol-1)的变化.
CH3OH(g)+H2O(g),如右上图表示该反应进行过程中能量(单位为kJ?mol-1)的变化.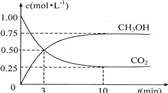
| 序号 | NaOH溶液的体积/mL | 盐酸的体积/mL | 溶液的pH |
| ① | 20.00 | 0.00 | 8 |
| ② | 20.00 | 20.00 | 6 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com