
题目列表(包括答案和解析)
| 1 | 10 |

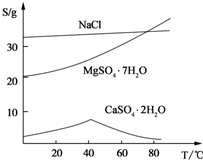
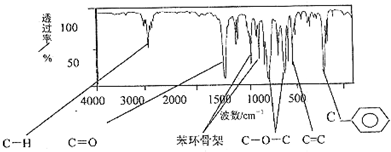


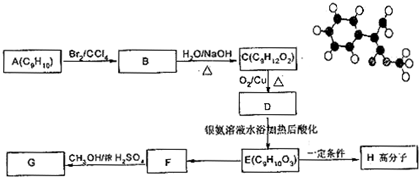


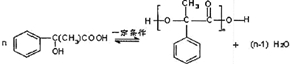

 表示(其中X、Y均不为H),试写出符合上述通式且能发生银镜反应和遇氯化铁溶液发生显色反应的2种物质的结构简式
表示(其中X、Y均不为H),试写出符合上述通式且能发生银镜反应和遇氯化铁溶液发生显色反应的2种物质的结构简式 (或其它合理答案)
(或其它合理答案) (或其它合理答案)
(或其它合理答案)

 4Fe(OH)3+8OH-+3O2↑.在提纯K2FeO4时采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用
4Fe(OH)3+8OH-+3O2↑.在提纯K2FeO4时采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用
| 实验方案(I) | 实验现象(Ⅱ) | 答案(III) | |
| 实验方案I | 实验现象II | ||
| 1.用砂纸擦后的镁带与沸 水反应,再向反应液中滴 加酚酞 |
A浮与水面,剧烈反应,放出气体, 熔成-个小球,在水面上无定向移 动,随之消失,溶液变红色. |
1 | |
| 2.向新制的H2S饱和溶 液中滴加新制的氯水 |
B.产生大量气体,可在空气中燃 烧,溶液变成浅红色 |
2 | |
| 3.钠与滴有酚酞的冷水反应 | C.反应不十分剧烈,产生的气体 可以在空气中燃烧 |
3 | |
| 4.镁带与2mol/L的盐酸 反应 |
D.剧烈反应,产生的气体可以在 空气中燃烧 |
4 | |
| 5铝条与2mol/L的盐酸 反应 |
E.生成白色絮状沉淀,继而沉淀 消失 |
5 | |
| 6.向AlCl2溶液中滴加NaOH溶液至过量 | F.生成淡黄色沉淀 | 6 | |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com