
题目列表(包括答案和解析)
(1)写出典例3中有关反应的离子方程式。
(2)将典例3中反应后所得溶液加热煮沸,有何现象?写出反应的离子方程式。
(3)若将标准状况下2.24 L二氧化碳通入400 mL 0.3 mol·L-1的氢氧化钾溶液中,生成何种物质?其物质的量分别是多少??
| 试管1 | 试管2 | 试管3 | |
| 步骤(2)的实验现象 | 出现白色沉淀 | ||
| 步骤(3)的实验现象 | 沉淀不溶解 | 沉淀不溶解 | |
| 蛋白质所表现的性质 | 盐析 | 变性 |
 (2010?上海)白磷(P4)是磷的单质之一,易氧化,与卤素单质反应生成卤化磷.卤化磷通常有三卤化磷或五卤化磷,五卤化磷分子结构(以PCl5为例)如右图所示.该结构中氯原子有两种不同位置.
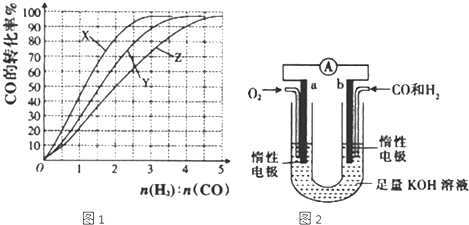
(2010?上海)白磷(P4)是磷的单质之一,易氧化,与卤素单质反应生成卤化磷.卤化磷通常有三卤化磷或五卤化磷,五卤化磷分子结构(以PCl5为例)如右图所示.该结构中氯原子有两种不同位置.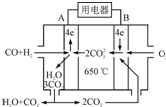 研究NO2、SO2、CO等大气污染气体的处理及利用的方法具有重要意义.
研究NO2、SO2、CO等大气污染气体的处理及利用的方法具有重要意义.湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com