
题目列表(包括答案和解析)
(09全国卷2,27)某温度时,在2L密闭容器中气态物质X和Y反应生成气态物质Z,它们的物质的量随时间的变化如表所示。
(1)根据表中数据,在图中画出X、Y、Z的物质的量(n)随时间(t)变化的曲线:
t/min | X/mol | Y/mol | Z/mol |
0 | 1.00 | 1.00 | 0.00 |
1 | 0.90 | 0.80 | 0.20 |
3 | 0.75 | 0.50 | 0.50 |
5 | 0.65 | 0.30 | 0.70 |
9 | 0.55 | 0.10 | 0.90 |
10 | 0.55 | 0.10 | 0.90 |
14 | 0.55 | 0.10 | 0.90 |
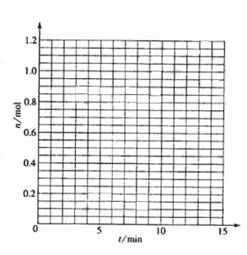
(2) 体系中发生反应的化学方程式是___________________________;
(3) 列式计算该反应在0-3min时间内产物Z的平均反应速率:_______________;
(4) 该反应达到平衡时反应物X的转化率![]() 等于___________________________;
等于___________________________;
(5) 如果该反应是放热反应。改变实验条件(温度、压强、催化剂)得到Z随时间变化的曲线①、②、③(如右图所示)则曲线①、②、③所对应的实验条件改变分别是:
① _________________ ②________________ ③__________________
(08年全国卷2)(13分)某钠盐溶液可能含有阴离子NO3-、CO32-、SO32-、SO42-、Cl-、Br-、I-、为鉴别这些离子,分别取少量溶液进行以下实验:
①测得混合液呈碱性;
②加HCl后,生成无色无味气体,该气体能使饱和石灰水溶液变浑浊;
③加CCl4后,滴加少量氯水,振荡后,CCl4后层未变色;
④加BaCl2溶液产生白色沉淀,分离,在沉淀中加入足量盐酸,沉淀不能完全溶解;
⑤加HNO3酸化后,再加过量AgNO3,溶液中析出白色沉淀。
(1)分析上述5个实验,写出每一步实验鉴定离子的结论与理由。
实验① ________ ;
实验② ________ ;
实验③ _________ ;
实验④ ________ ;
实验⑤_________ ;
(2)上述5个实验不能确定是否存在的离子是 ________ 。
Q、R、X、Y、Z为前20号元素中的五种,Q的低价氧化物与X单质分子的电子总数相等,R与Q同族,Y和Z的离子与Ar原子的电子结构相同且Y原子序数小于Z。
(1)Q的最高价氧化物,其固态属于___ 晶体,俗名叫 _____ :
(2)R的氢化物分子的空间构型是_____ ,属于_____ 分子(填“极性”或“非极性”);它与X形成的化合物可作为一种重要的陶瓷材料,其化学式为 _____ ;
(3)X的常见氢化物的空间构型是______ ,它的另一氢化物X2H4是火箭燃料的成分,其电子式是____ ;
(4)Q分别与Y、Z形成的共价化合物的化学式是____ 和____ ;Q与Y形成的化合物的电子式为____ ,属于____ 分子(填“极性”或“非极性”)。
(06年全国卷2)(15分)已知X、Y、Z都是短周期的元素,它们的原子序数依次递增。X原子的电子层数与它的核外电子总数相同,而Z原子的最外层电子数是次外层的三倍,Y和Z可以形成两种以上气态化合物,则
(1)X是____ ,Y是 _____ ,Z是_____。
(2)由Y和Z组成,且Y和Z的质量比为7:20的化合物的化学式(分子式)是_____ 。
(3)由X、Y、Z中的两种元素组成,且与X、Z分子具有相同电子数的两种离子是__________和 _____ 。
(4)X、Y、Z可以形成一种盐,此盐中X、Y、Z元素的原子的个数比为423,该盐的化学式(分子式)是____ 。
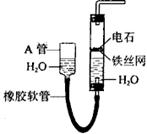 (05年全国卷2)(16分)下图中的实验装置可用于制取乙炔。请填空:
(05年全国卷2)(16分)下图中的实验装置可用于制取乙炔。请填空:
(1)图中,A管的作用是 。制取乙炔的化学方程式是 。
(2)乙炔通入KMnO4酸性溶液中观察到的现象是 ,乙炔发生了 反应。
(3)乙炔通入溴的CCl4溶液中观察到的现象是 ,乙炔发生了 反应。
(4)为了安全,点燃乙炔前应 ,乙炔燃烧时的实验现象是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com