
题目列表(包括答案和解析)
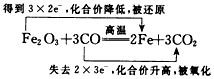
(1)单线桥法:

反应中电子转移数目x=__________________,氧化剂是__________________,还原剂是__________________。
(2)双线桥法:
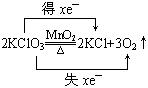
反应中,KClO3中的氯元素共得__________________电子,化合价__________________,被_________________,氧元素共失去__________________电子,化合价__________________,被__________________;氧化剂是__________________,还原剂是__________________。



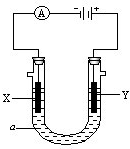
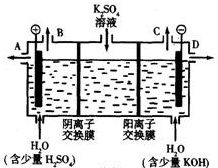
| aNa |
| 58.5 |
| b |
| 58.5 |
| b |
| a |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com