
题目列表(包括答案和解析)
CuSO4溶液与K2C2O4溶液混合生成一种蓝色钾盐水合物KaCub(C2O4)c·nH2O。通过下述实验确定该晶体的组成。
步骤a:称取0.6720 g样品,放入锥形瓶,加入适量2mol·L-1稀硫酸,微热使样品溶解。再加入30 mL水加热,用0.2000mol·L-1 KMnO4溶液滴定至终点,消耗8.00 mL KMnO4溶液。有关反应:2MnO4-+5C2O42-+16H+=2Mn2++8H2O+10CO2↑
步骤b:接着将溶液充分加热。冷却后,调节pH并加入过量的KI固体,溶液变为棕色并产生白色沉淀CuI。用0.2500mol·L-1 Na2S2O3标准溶液滴定至终点,消耗8.00 mL Na2S2O3溶液。滴定时反应为:I2+2S2O32-=2I-+S4O62-
(1)步骤b中生成白色沉淀的离子方程式: 。
(2)步骤b中“将溶液充分加热”的目的是 。
(3)请完成下列确定样品组成的计算过程。
①计算样品中n (C2O42-)(写出计算过程)
②计算样品中n (Cu2+) (写出计算过程)
③根据 原理可求出n (K+),再依据 原理求得n (H2O)
④该样品晶体的化学式为
某溶液含有Na+、Al3+、Fe2+、Cl-、NO![]() 、HCO
、HCO![]() 、I- 等离子中的若干种.依次进行下列实验,现象如下:
、I- 等离子中的若干种.依次进行下列实验,现象如下:
①用pH试纸检验,溶液的pH<7;
②取少量溶液滴加氯水,再加入CCl4振荡、静置,下层显紫红色,而后分液;
③向实验②分液后所得的水溶液中加入AgNO3与HNO3的混合溶液,有白色沉淀产生;
④另取少量原溶液加入过量NaOH溶液,产生白色沉淀并迅速变为灰绿色,最后变为红褐色,然后过滤;
⑤向实验④所得滤液中通入过量CO2气体,有白色沉淀产生.
请回答下列问题:
(1)原溶液中肯定存在的离子有________,肯定不存在的阴离子有________.
(2)实验④中白色沉淀变为红褐色的化学反应方程式为________.
(3)实验⑤中产生白色沉淀的离子方程式是________.
下列各溶液的叙述中不正确的是(???? )
A.等pH的硫酸与醋酸稀释后pH的变化如图所示,则曲线Ⅱ表示的是醋酸的稀释图像
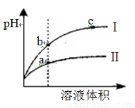
B.溶有等物质的量的NaClO、NaHCO3的溶液中:c(HClO)+c(ClO-)=c(HCO3-)+c(H2CO3)+c(CO32-)
C.若NH4HCO3溶液、NH4HSO4溶液中c(NH4+)相等,则: c(NH4HSO4)<c(NH4HCO3)
D.已知某温度下Ksp(CH3COOAg) = 2.8×10-3,浓度均为0.1 mol·L-1的AgNO3溶液和CH3COONa溶液等体积混合一定能产生CH3COOAg沉淀
下列各溶液的叙述中不正确的是( )
A.等pH的硫酸与醋酸稀释后pH的变化如图所示,则曲线Ⅱ表示的是醋酸的稀释图像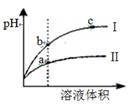 |
| B.溶有等物质的量的NaClO、NaHCO3的溶液中:c(HClO)+c(ClO-)=c(HCO3-)+c(H2CO3)+c(CO32-) |
| C.若NH4HCO3溶液、NH4HSO4溶液中c(NH4+)相等,则: c(NH4HSO4)<c(NH4HCO3) |
| D.已知某温度下Ksp(CH3COOAg) = 2.8×10-3,浓度均为0.1 mol·L-1的AgNO3溶液和CH3COONa溶液等体积混合一定能产生CH3COOAg沉淀 |
一、选择题(本题包括9小题.每小题3分.共27分.每小题只有一个答案正确)
题号
1
2
3
4
5
6
7
8
9
答案
B
D
B
D
B
C
D
D
A
二、选择题(本题包括9小题,每小题4分,共36分.每小题有一个或两个选项符合题意.若
正确答案包括一个选项.多选时.该题为0分;若正确答案包括两个选项,只选一个且正确得2分.选两个且都正确得4分.但只要选错一个,该小题为0分)
题号
10
11
12
13
14
15
16
17
18
答案
AC
C
A
BC
B
AB
C
AD
C
三、(本题包括3小题,共33分)
19.(10分)(1)静置一段时间后.取少量上层澄清溶液再漓加BaCl2溶液,若无沉淀生成,说明SO42-沉淀完全,反之未沉淀完全;(3分)
(2)否,会引入硝酸钾杂质.(2分)
(3)(5分,每处1分。三种或二种物质的缺一种就不给分)。
①KCI、KBr、BaCl2 ② K2CO3 ③BaCO3 ④KCI、KBr、KCO3 ⑤HCL和CL2
20.(11分)(1)0.0020(2分)
 (2)1.8mol?L-1(3分,数据2分,单位1分)
(2)1.8mol?L-1(3分,数据2分,单位1分)
(3)变浅(2分)
(4)D(2分)l(5)60℃曲线(2分)
21.(12分)SO2和品红溶液反应生成无色物质(2分)
(1)①检查装置的气密性(2分); ②KMnO4溶液刚好褪色(2分)
③通入空气至酸性KMnO4溶液刚好褪色所需要的时间 (2分)
(2)①工厂尼气、汽车尾气中SO2音量较高(1分) ②提高脱硫技术(或改用更洁净的能源或提高尾气的处理技术琥对尾气进行综合利用等合理答案均可)(1分)
(3)①:可照是下雨时SO2和水反应降低了雨后空气中SO2的含量(1分);
②:风速越大。气体扩散速度越大。空气中SO2浓度越小(1分)。
四、(本题包括4小题,共44分)
22.(10分)(1)安装好装置并在量气管内加人水,向下移动水准管,静置片刻.若水准管中液面与量气管液面维持一定的高度差,说明装量密封(合理即给分)(2分)
(2)2OH-+2AI+2H2O = 2AIO2-+3H2 ↑ (或写成[AI(OH)4]-)(2分)
(3)0<mal<0.04g(或mal<0.04g,2分) (4)>(2分) (5)符合标准(2分)
23.(14分)(1)排除装置内的空气,w.w.w.k.s.5 u.c.o.m防止NO被空气中的O2氧化(2分)
(2)在C中水蒸气被冷却成液态水,它与NO2或N2O4反应生成N0,干扰NO的验证(2分)
(3)D瓶内气体由无色变为红棕色(1分);2NO+02=2NO2(2分);
(4)把NO2全部转化为N如.晶体.避免在D装置中对N0的验证产生干扰(2分)l防止倒吸(1分)
(5)②用蒸馏水洗涤烧瓶2-3次.洗液也倒人烧杯中(1分),然后加人过量的NaCl溶
液(1分),过滤、洗涤、烘干、称AgCl(1分),计算Ag的质量及质量分数(1分)
24.(10分)
(1)Cu+2HN03+H2S04=CuS04+2N02↑+2H2O(2分)
(2)HNO3(2分)
(3)①
 |
②吸收尾气(2分)
(4)浓硫酸与Cu直接反应需要加热;浓硫酸产生的SO2在此实验中难以循环利用愿料利用率低并污染空气。(2分)
25.(10分)(1)②(1分);酸性KMnO4会氧化C6H5―NH2生成焦油状的复杂物质(1分)
 (2)HOOC- 《 -NO2(2分) (3)聚合(缩聚);加成(2分)
(2)HOOC- 《 -NO2(2分) (3)聚合(缩聚);加成(2分)
(4)C6H5-CH2Cl+NaOH->C6H5-CH20H+NaCl(2分)

(2分)
五、(本题包括2小题,每题10分,但只能选做其中的一题)
26.(10分)(1)HOOC―COOH(1分);羧基、羟基(1分,只答一种不给分) (2)b (1分)
 (3)HOCH2―CH20H+O2
OHC―CHO+2H20(2分)
(3)HOCH2―CH20H+O2
OHC―CHO+2H20(2分)
(4)HOOC―CH2―CH(OH)一COOH H00C―CH=CH―COOH+H2O(2分)
H00C―CH=CH―COOH+H2O(2分)
 |
(5) (2分) (6)2(1分)
27.(10分)(1)I?IIA(1分)
Ⅱ.IVA(1分);b(1分);a点所示的氢化物是水,其沸点高是由于水分子间存在氢键,所以氧族元素中它氢化物的沸点不会高于水。(2分)
(2)I.3d24s2(1分) Ⅱ.①BaTiO3(1分) 6(1分);②[TiCl(H2O)5]Cl2?H2O(2分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com