
题目列表(包括答案和解析)
| Ⅰ:下列有关实验的描述不正确的是____(填序号); ①用盐酸标准溶液滴定待测的氢氧化钠溶液时,水洗后的酸式滴定管未经标准溶液润洗,则测定结果偏低。 ② 配制一定物质的量浓度的溶液时,俯视容量瓶的刻度线,会使配制的浓度偏高; ③ 将Fe2(SO4)3溶液加热蒸发至干并灼烧,最后得到红棕色粉末 ④ 硝酸钾过饱和溶液冷却未出现结晶时,可以用玻棒充分磨擦器皿壁促使晶体析出。 ⑤可用25ml酸式滴定管量取20.00mlKMnO4溶液 ⑥分别向体积和pH均相同的盐酸和醋酸中滴加等浓度的氢氧化钠溶液,完全中和时消耗的氢氧化钠溶液的体积一样多 Ⅱ:三氧化二铁和氧化亚铜都是红色粉末,常用作颜料。某校一化学实验小组通 过实验来探究红色粉末是Fe2O3、Cu2O或二者混合物。探究过程如下: 查阅资料:Cu2O是一种碱性氧化物,溶于稀硫酸生成Cu和CuSO4,在空气中加热生成CuO。 提出假设 假设1:红色粉末是Fe2O3 假设2:红色粉末是Cu2O 假设3:红色粉末是Fe2O3和Cu2O的混合物 设计探究实验 取少量粉末放入足量稀硫酸中,在所得溶液中再滴加KSCN试剂。 (1)若假设1成立,则实验现象是_________________。 (2)若滴加KSCN试剂后溶液不变红色,则证明原固体粉末中一定不含三氧化二铁。你认为这种说法合理吗?_________________。简述你的理由(不需写出反应的方程式)___________________。 (3)若固体粉末完全溶解无固体存在,滴加KSCN试剂时溶液不变红色,则证明原固体粉末是____________,写出发生反应的离子方程式________________。 探究延伸 经实验分析,确定红色粉末为Fe2O3和Cu2O的混合物。 (4)实验小组欲用加热法测定Cu2O的质量分数。取ag固体粉末在空气中充分加热,待质量不再变化时,称其质量为bg(b>a),则混合物中Cu2O的质量分数为________。 (5)实验小组欲利用该红色粉末制取较纯净的胆矾(CuSO4·5H2O)。经查阅资料得知,在溶液中通过调节溶液的酸碱性而使Cu2+、Fe2+、Fe3+分别生成沉淀的pH如下: | ||||||||||||
| ||||||||||||
| 实验室有下列试剂可供选择: A、氯水 B、H2O2 C、NaOH D、Cu2(OH)2CO3 实验小组设计如下方案 | ||||||||||||
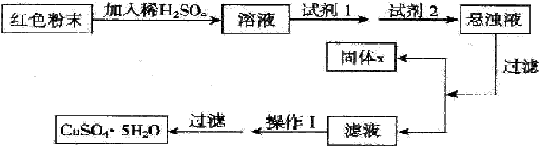 | ||||||||||||
| 试回答: ①试剂1为_______,试剂2为________(填字母)。 ②固体X的化学式为____________。 ③操作I为___________。 |
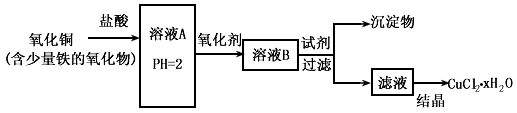
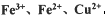 。检验溶液A中含有Fe2+的最佳试剂为_______(填编号,下同)
。检验溶液A中含有Fe2+的最佳试剂为_______(填编号,下同) 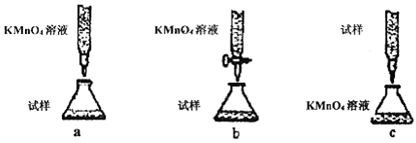
(Ⅰ)某化学兴趣小组的同学得上用下图所示实验装置进行实验(图中a、b、c表示止水夹)。
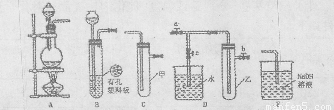
(1)请利用上述装置设计一个简单的实验验证Cl-和Br-的还原性强弱。
①选择合理的装置连接: → → (填字母编号)。
②选择所需的试剂: (填字母编号)。
a.固体氯化钠 b.固体二氧化锰 c.浓硫酸
d.浓盐酸 e.稀盐酸 f.溴化钠溶液
③实验现象及结论: 。
(Ⅱ)电极材料由Ni(OH)2、碳粉、氧化铁等涂覆在铝箔上制成。由于电池使用后电极材料对环境有危害,某兴趣小组对该电池电极材料进行资源回收并制备NiSO4·7H2O晶体,设计实验流程如下:
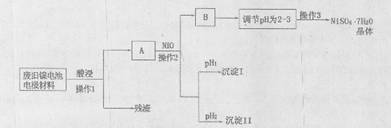
已知:①NiSO4易溶于水,Fe3+不能氧化Ni2+
②某温度下一些金属氢氧化物的KSP及析出理论pH如下表所示:
|
M(OH)n |
Ksp[来源:学_科_网][来源:学#科#网Z#X#X#K] |
pH |
|
|
开始沉淀 |
沉淀完全 |
||
|
Al(OH)3 |
1.9×10-23 |
3.43 |
4.19 |
|
Fe(OH)3 |
3.8×10-38 |
2.53 |
2.94 |
|
Ni(OH)2 |
1.6×10-14 |
7.60 |
9.75 |
回答下列问题:
(1)根据上表数据判断操作2依次析出的沉淀I是 沉淀II是 (填化学式),pH1 pH2(填“>”、“<”或“=”);
(2)操作1和操作2所用到的仪器除铁架台(带铁圈)、酒精灯、烧杯、玻璃棒外还需要的主要仪器为 。
(3)“调节pH为2-3”的目的是 ;
(4)NiSO4在强碱溶溶中用NaClO氧化,可制得碱性镍镉电池电极材料——NiOOH。该反应的离子方程式是 。
(14分)
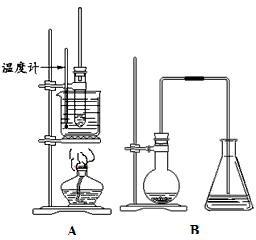
研究小组用下图装置制取Cl2,证明产生的气体中含有HCl。
(1)仪器A的名称为 ;A中反应的离子方程式为 。
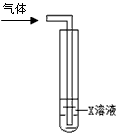
(2)甲同学将A中产生的气体通入下列溶液:
| 实验序号 | 试剂 | 现象 |
| a | 紫色石蕊溶液 | |
| b | AgNO3溶液 | 出现白色沉淀 |
1.C 2.B 3.B 4.D 5.C 6.B 7.D 8.A 9.C 10.C 11.A
12.D 13.C 14.C 15.C 16.D 17.B 18.B
19.(12分)
(1)CO32- + H2O  HCO3- + OH- (2分)
HCO3- + OH- (2分)
(2)不再有气泡产生(或只有极少量气泡产生)(2分)
(3)玻璃棒(2分)
(4)4Fe2+ + O2 + 4H+ = 4Fe3+ + 2H2O (2分)
(5)6.6 (2分)
(6)循环使用 (2分)
20.(6分)
(1)Na+[ ]2- Na+ (2分)
]2- Na+ (2分)
(2)C2H6-14e-+18OH- =2CO32-+12H2O (2分)
(3) c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-) (2分)
21.(8分)
(1)C + 4HNO3(浓) CO2 ↑ + 4NO2 ↑ + 2H2O (2分,不写条件不得分)
CO2 ↑ + 4NO2 ↑ + 2H2O (2分,不写条件不得分)
SiO32-+CO2 +H2O = H2SiO3↓+CO32 (2分)
(2)8Al+3Fe3O4 9Fe+
9Fe+
Al2O3+2OH-=2AlO2-+H2O (2分)
22.(14分)
(1)增大(2分)
(2)不移动 (2分)
 (3)
(3)
(各占2分,起点位置、曲线走势、终点与原曲线的
相对高低等只要有一处错误则不得分。)
(4)(4分)
0.60(2分)
ν正_>_ν逆(2分)
(5)787.0 (2分)
23:(14分)
(1)羟基;(2分,写结构简式不得分)
 (2)CH2=CH-CH2-OH;(2分)
(2)CH2=CH-CH2-OH;(2分)

 (3)任意1种均可(2分)
(3)任意1种均可(2分)
(4) ① b (2分)
 ②ClCH2COOH,取代反应;(各2分)
②ClCH2COOH,取代反应;(各2分)
③ (2分
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com