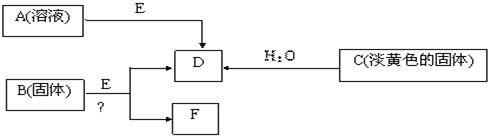
(2011?武胜县一模)现有短周期元素组成的A、B、C、D、E五种物质,存在如下转化关系(部分产物已略去),其中E为黑色粉末,D为无色气体.
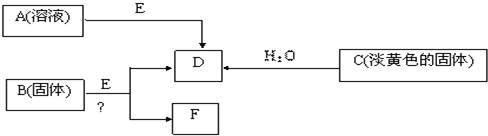
(1)若B为含氯元素的钾盐,与浓盐酸反应可以生成黄绿色气体,且1mol B转移5mol 电子,则B与浓盐酸反应的化学方程式为
KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O
KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O
. 生成的氧化产物与还原产物的物质的量之比为
5:1
5:1
;
(2)将F从混合物中分离出来的实验操作步骤为
溶解
溶解
、
过滤
过滤
、
蒸发
蒸发
.由A制得2mol D时,转移电子数为
4
4
mol
(3)电解F的饱和水溶液得到碱溶液M,写出该反应的离子方程式;
,若将浓度为 c mol?L
-1 的M溶液与0.2mol?L
-1 的一元酸HA等体积混合,所得溶液pH=7.溶液中离子浓度的大小关系为
c(K+)=c(A-)>c(OH-)=c(H+)
c(K+)=c(A-)>c(OH-)=c(H+)
(浓度用C表示).
(4)固体C与FeCl
3溶液按物质的量为2:1反应的离子方程式
2Na2O2+Fe3++2H2O=Fe(OH)3↓+4Na++O2↑+OH-
2Na2O2+Fe3++2H2O=Fe(OH)3↓+4Na++O2↑+OH-
;
将Fe(OH)
3和NaOH与NaClO混合作用后,是制得緑色水处理剂(Na
2FeO
4)的一种方法,请完成下列方程式:
2
2
Fe(OH)
3+
4
4
NaOH+
3
3
NaClO=
2
2
Na
2FeO
4+
3
3
NaCl+
5
5
H
2O.